서 언
재료 및 방법
재료 및 추출물 제조
균주 배양
총 지질 함량 분석
중성지방 함량 분석
유지효모내 지방구 염색
세포수 측정
유리지방산의 측정
총 카로티노이드 함량 분석
통계 분석
결과 및 고찰
비트 용매별 추출물의 중성지방 억제 효과
비트 열수추출물의 중성지방 억제 효과
유지효모내 지방구 염색
세포수 측정
유리지방산의 함량 변화
총 카로티노이드 함량 분석
적 요
서 언
현대사회는 생활수준의 향상으로 식생활의 서구화, 생활환경의 변화에 따른 과다 영양섭취와 비활동적 생활습관으로 인하여 과체중 및 비만 환자가 점차 증가되고 있다(Kim et al., 2017; Lim, 2006). 비만은 과다하게 섭취되어 소비되지 못한 에너지가 중성지방으로 과도하게 축적되어 있는 상태를 의미하며 각종 암, 고혈압, 당뇨병, 심혈관계 질환 등 각종 질환의 발병 원인으로 알려지면서 현재 전세계적으로 심각한 영양문제로 대두되었다(Tyrovolas and Panagiotakos, 2010). 비만은 지방전구세포의 분화 및 지질합성 과정에 의해 지방세포내 중성지방의 축적으로 발생되며, 지방세포내 중성지방의 합성을 억제하는 것이 비만 억제의 효과적인 치료방법으로 알려져 있다(Chen and Farese Jr, 2005; Park et al., 2013). 지금까지 비만 관련 작용 기전을 규명하기 위한 연구에는 생쥐의 배아에서 유래된 지방전구세포인 3T3-L1 지방세포를 주로 이용해왔으나 편리하고 경제적인 반면 지속적인 계대 배양이 어렵고 세포 유지 및 보관 중 세포의 손상을 발생하는 등의 문제점이 있어 새로운 지방세포 모델의 필요성이 요구되어 왔다(Wolins et al., 2006). 이담자균 효모 Rhodosporidium toruloides (R. toruloides)는 트리아실글리세롤, 카로티노이드 및 리놀렌산의 생산을 증가시켜 미생물 바이오디젤 분야에서 R. toruloides의 연구에 대한 관심이 커지고 있다(Kim and Yoon, 2015). R. toruloides는 건조 균체의 최대 65% 이상의 균체 지방질을 축적하며 lignocellulosic hydrolysates를 통해 억제 화합물에 대한 내성이 뛰어나 지방세포 대사의 모델로 제안이 되고 있다(Tiukova et al., 2019). 명아주과의 비트(Beta vulgaris L., Beetroot)는 칼로리가 낮고 천연의 미네랄과 비타민이 풍부하다고 알려져 있다(Kim et al., 2010). Boo et al. (2011)은 천연색소 추출물에 대하여 레드비트 물 추출물의 수소전자공여능과 아질산염 소거 활성을 통해 항산화 효과를 확인하였으며, Lee et al. (2017)은 비트 에탄올 추출물의 항산화 효과와 비트 헥산 추출물의 세포내 항염 효과를 보고하였다. Jang et al. (2009)은 비트 유기용매 추출물의 결장암과 위암세포의 증식억제 및 세포내 활성산소종 억제효과를 보고하였으며, Kapadia et al. (1996)은 비트 에탄올 추출물의 체내 종양 억제효과를 확인하여 피부암과 폐암의 예방효과를 보고하였다. Jung (2018)은 비트 에탄올 추출물이 지질다당류 및 알코올로 유도된 간 손상에 대한 보호효과를 보고하였다. 비트 추출물들에 의한 다양한 연구 진행에도 불구하고 유지효모를 활용한 비트 추출물의 항비만 효과에 관한 연구는 아직 보고된 바 없다. 따라서 본 연구는 R. toruloides를 활용하여 비트 추출물의 중성지방 억제효과를 확인하기 위해 수행되었다.
재료 및 방법
재료 및 추출물 제조
본 시험에 사용된 비트(Beta vulgaris L.)는 전라북도 익산 농원으로부터 공급받아 사용하였다. 비트를 분쇄하여 열수와 30% 및 60% 에탄올 10배량(w/v)을 가하여 60℃에서 3시간 동안 추출하였다. 추출물은 감압 농축기(EYELA, Rikakikai, Japan)를 활용하여 농축 후 동결건조하여 분말 형태로 회수하였으며, -20℃에서 보관하면서 사용하였다.
균주 배양
비트 추출물의 중성지방 억제효과에 대한 분석은 Jeong (2016)의 방법을 이용하였다. 실험에 사용된 유지효모 R. toruloides는 한국생명공학연구원 생물자원센터에서 분양받아 사용하였다. YPD 액체배지(1% yeast extract, 2% peptone, 2% dextrose)에 유지효모를 0.1% (v/v) 접종하여 25℃에서 180 rpm으로 72시간 동안 배양하였다. 실험구는 YPD 액체배지에 비트 추출분말을 0.02, 0.1 및 0.5% (w/v)로 첨가하여 용해시킨 후 121℃에서 15분간 고압 멸균하여 사용하였다. YPD 액체배지에 유지효모를 0.1% (v/v) 접종하여 25℃에서 180 rpm으로 72시간 동안 배양하였다. 배양 종료 후 비트 추출물 배양액을 4℃에서 3,000 rpm으로 15분간 원심분리하여 상층액을 제거한 후 60℃의 건조기에서 60분간 건조한 균체량을 총 지질 함량과 중성지방 함량 분석에 사용하였다.
총 지질 함량 분석
유지효모의 총 지질 함량은 Sha (2013)의 방법을 변형하여 사용하였다. 건조시킨 유지효모에 4 M 염화수소 3.2 mL을 첨가 및 혼합한 다음 유리관에 옮긴 후 55℃의 항온수조에서 2시간 동안 반응시켰다. 이어 클로로포름과 메탄올의 혼합액(1:1, v/v) 8 mL을 첨가한 후 20℃에서 220 rpm으로 3시간 동안 추출하였다. 추출액을 4℃에서 3,000 rpm으로 15분간 원심분리하여 클로로포름 층을 회수한 후 질소 농축한 중량으로 총 지질 함량을 계산하였다.
중성지방 함량 분석
유지효모의 중성지방 함량은 아산제약(Seoul, Korea)의 중성지방 측정용 키트를 사용하여 측정하였다. 중성지방 표준용액에 조제한 반응시약을 유리관에 3 mL씩 분주하였다. 질소 농축한 유지효모는 디메틸설폭사이드(Junsei Chemical Co., Tokyo, Japan)로 용해하여 유리관에 0.02 mL을 첨가하여 혼합하고 37℃에서 10분간 반응시킨 후, 550 ㎚에서 흡광도를 측정하였다. 중성지방 함량 계산법은 다음과 같다.
중성지방 함량(㎎/dL) = (검체의 흡광도/표준의 흡광도) × 300
유지효모내 지방구 염색
Nile red는 효모, 조류 및 곰팡이 등 다양한 생물학적 시스템에서 세포내 지질 함량 검출과 정량화하는데 사용되어 왔다(Sitepu et al., 2012). 유지효모내의 지방구 염색은 Kimura et al. (2004)의 방법을 이용하여 확인하였다. 유지효모 배양액 0.1 mL에 0.1 M 인산완충용액(pH 7.4) 2 mL을 첨가한 다음 아세톤에 용해한 0.0001% (w/v) Nile red 용액(9-diethylamino-5H- benzo [α] phenoxazine-5-one, Sigma, USA)을 0.01 mL을 첨가하였다. 혼합액을 암실에서 5분간 방치시킨 후, 현미경(Zeiss, Oberkochen, Germany)을 이용하여 확인하였다.
세포수 측정
유지효모의 세포수 계수는 혈구계수기를 이용하여 측정하였다. YPD 액체배지에 0.02, 0.1 및 0.5% (w/v)의 비트 열수추출 분말을 첨가하여 유지효모 0.1% (v/v)를 접종한 후 25℃에서 180 rpm으로 72시간 동안 배양하였다. Eppendorf tube에 배양액을 0.1 M 인산완충용액(pH 7.4)에 10배량(v/v)을 희석한 후, 희석한 배양액 0.01 mL을 혈구계수기에 주입하여 현미경(Zeiss, Oberkochen, Germany)으로 관찰하였다.
유리지방산의 측정
유리지방산은 Chea et al. (2007)의 방법을 이용하여 측정하였다. 유지효모를 배양한 시료 10 g을 에틸에테르와 에탄올의 혼합액(2:1, v/v) 100 mL을 첨가하여 녹인 다음 1% 페놀프탈레인 용액 2-3방울을 가한 후 0.1 N 에탄올성 수산화칼륨 용액으로 적정하였다. 용액이 미홍색으로 30초간 지속될 때를 종말점으로 하여 산가를 측정하였다.
산가(㎎/g) = 5.611×(a-b)×F/S
a: 본시험의 0.1 N 에탄올성 수산화칼륨 용액의 적정소비량(mL)
b: 공시험의 0.1 N 에탄올성 수산화칼륨 용액의 적정소비량(mL)
F: 0.1 N 에탄올성 수산화칼륨 용액의 역가
S: 시료채취량(g)
총 카로티노이드 함량 분석
유지효모내의 카로티노이드 함량은 Kim et al. (2015)의 방법을 이용하여 분석하였다. 유지효모를 배양한 시료를 4℃에서 15분간 3,000 rpm으로 원심분리 후 침전물을 이용하였다. 침전물에 클로로포름과 메탄올의 혼합액(1:1, v/v) 5 mL을 첨가하여 상온에서 21시간 추출한 다음 pore size 0.45 ㎛ 여과지로 여과하여 470 ㎚에서 흡광도를 측정하였다. 총 카로티노이드 함량 계산법(Lee et al., 2017)은 다음과 같다.
총 카로티노이드(㎍/g) = (A×V)/A1%1cm×S
A : 470 ㎚에서의 흡광도
V : 추출액의 총 부피(mL)
A1%1cm : 클로로포름: 메탄올(1:1)에서의 β-carotene 흡수 계수
S : 시료채취량(g)
통계 분석
모든 실험은 3회 반복하여 결과를 도출했으며, SPSS ver.12.0 통계 프로그램(IB-M, Chicago, USA)을 이용하여 평균±표준편차(Mean±S.D.)로 계산하였다. 각 시험군 간의 통계적 유의성 검정에 따른 통계분석은 ANOVA (one-way analysis of variance test)를 실시한 후 유의성이 있는 경우, p < 0.05 미만일 때 Ducan’s multiple range test로 사후 검정하였다.
결과 및 고찰
비트 용매별 추출물의 중성지방 억제 효과
비트 열수추출물, 30% 및 60% 에탄올 추출물을 첨가한 YPD 배지에서 배양한 유지효모의 중성지방의 함량은 Fig. 1과 같다. 대조구, 실험대조구, 비트 열수추출물, 30% 및 60% 에탄올 추출물을 첨가한 유지효모의 중성지방 함량은 각각 8.76, 3.43, 2.87, 3.16 및 3.64 ㎎/dL로 나타났다. 대조구에 비해 실험대조구, 열수추출물, 30% 및 60% 에탄올 추출물을 첨가한 유지효모의 중성지방 억제효과는 각각 60, 67, 63 및 58%로 나타났으며, 비트 열수추출물을 첨가한 유지효모의 중성지방 억제효과가 가장 높았다. 중성지방 억제효과와 유지효모의 세포수와의 상관관계를 규명하기 위하여 비트 열수추출물을 첨가한 유지효모의 세포수를 계수한 결과는 Table 1과 같다. 대조구, 실험대조구, 비트 열수추출물, 30% 및 60% 에탄올 추출물을 첨가한 유지효모의 세포수는 각각 10.48, 8.46, 12.40, 12.80 및 8.24×103 cell/mL로 나타났다. 대조구에 비해 실험대조구, 비트 열수추출물 및 30% 에탄올 추출물을 첨가한 유지효모의 세포수는 유의적으로 증가한 반면 비트 60% 에탄올 추출물을 첨가한 유지효모의 세포수는 오히려 감소하였다. Lee and Chin (2012)의 연구결과에 의하면 비트 물 추출물이 에탄올 추출물보다 항산화 활성이 높은 결과를 보고하였는데 본 연구에서도 비트 열수추출물이 유지효모의 성장을 촉진시킨 결과와 중성지방 억제효과가 가장 높은 결과로부터 중성지방 억제효과가 나타내는 유효성분은 수용성 물질임을 확인하였다. 따라서 유지효모의 중성지방의 억제효과에 대해 비트 추출물 중 열수추출물이 억제효과를 가장 높게 나타낸 결과로부터 비트 열수추출물을 선별하였다.
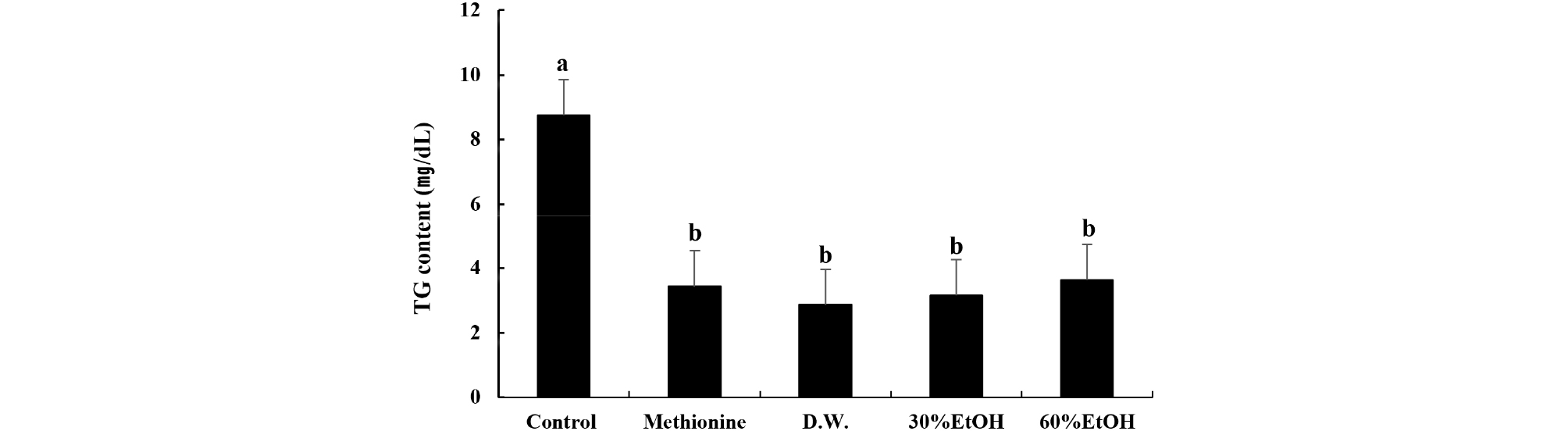
Fig. 1.
Triglyceride content of R. toruloides according to beetroot different solvent extract treatment. Control, R. toruloides incubated in YPD medium without beetroot extract; Methionine, R. toruloides incubated in YPD medium with 0.0001% methionine; D.W., R. toruloides incubated in YPD medium with 0.1% of beetroot hot water extract; 30% EtOH and 60% EtOH. R. toruloides incubated in YPD medium with 0.1% of beetroot 30% ethanol extract and beetroot 60% ethanol extract, respectively. a-b) Means not sharing a common letter are significantly different among groups (p <0.05).
Table 1. Cell number of R. toruloides according to beetroot different solvent extract treatment
| SampleZ | Cell number (×103 cell/mL) |
| Control | 10.48±0.44b |
| Methionine | 8.46±0.65c |
| D.W. | 12.40±0.94a |
| 30% EtOH | 12.80±1.32a |
| 60% EtOH | 8.24±0.97c |
비트 열수추출물의 중성지방 억제 효과
비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모의 총 지질 함량의 결과는 Fig. 2와 같다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 총 지질 함량은 각각 112.29, 38.90, 147.87, 211.36 및 291.89 ㎎/g로 나타났으며, 비트 열수추출물의 첨가 농도에 따라 총 지질 함량이 농도의존적으로 증가하였다. 비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모의 중성지방 함량을 분석한 결과는 Fig. 3과 같다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 중성지방의 함량은 각각 6.02, 2.83, 2.38, 1.37 및 0.73 ㎎/dL로 나타나 대조구에 비해 각각 52, 60, 77 및 87%의 중성지방 억제효과를 보였으며, 이중 가장 낮은 비율의 0.02% 비트 열수추출물을 첨가한 실험구도 지질과산화물을 분해하는(Zhang et al., 2003) 메티오닌보다 높은 억제효과를 나타내었다.
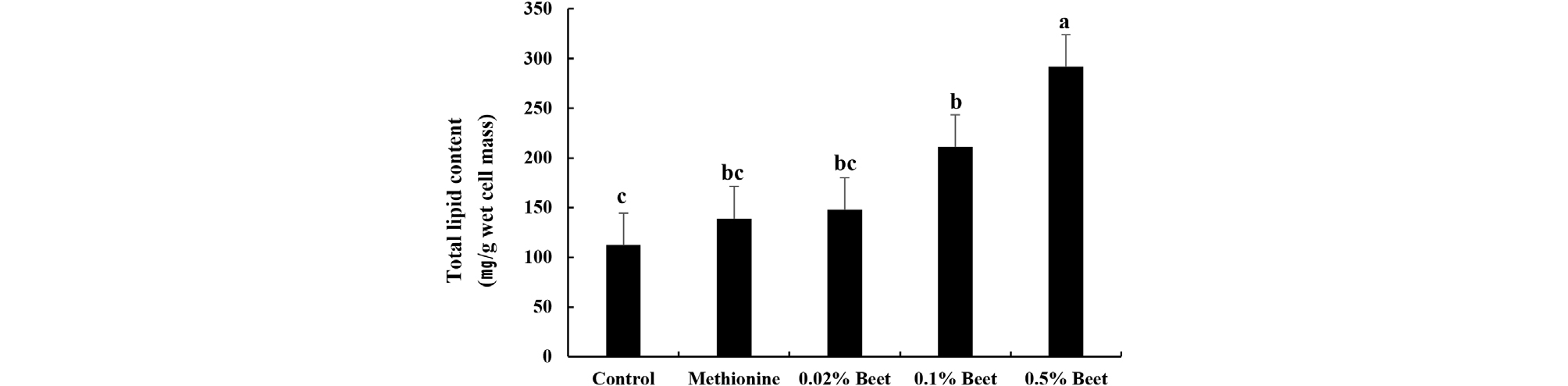
Fig. 2.
Total lipid content of R. toruloides according to beetroot hot water extract treatment. Control, R. toruloides incubated in YPD medium without beetroot hot water extract; Methionine, R. toruloides incubated in YPD medium with 0.02% methionine; 0.02%, 0.1% and 0.5% Beet, R. toruloides incubated in YPD medium with 0.02%, 0.1% and 0.5% beetroot hot water extract, respectively. a-c) Means not sharing a common letter are significantly different among groups (p<0.05).
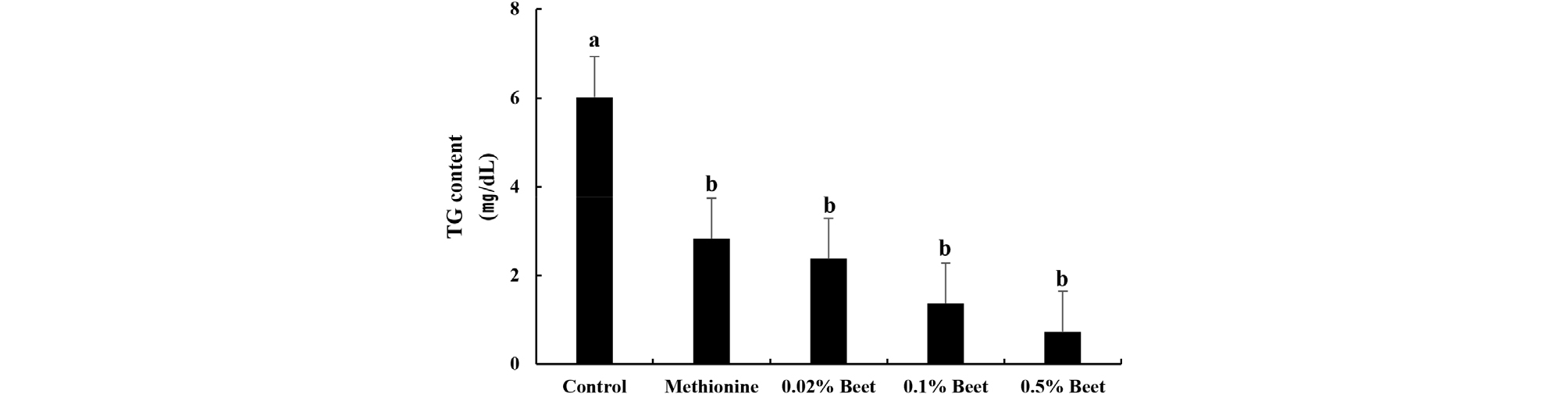
Fig. 3.
Triglyceride content of R. toruloides according to beetroot hot water extract treatment. Control, R. toruloides incubated in YPD medium without beetroot hot water extract; Methionine, R. toruloides incubated in YPD medium with 0.02% methionine; 0.02%, 0.1% and 0.5% Beet, R. toruloides incubated in YPD medium with 0.02%, 0.1% and 0.5% beetroot hot water extract, respectively. a-b) Means not sharing a common letter are significantly different among groups (p<0.05).
유지효모내 지방구 염색
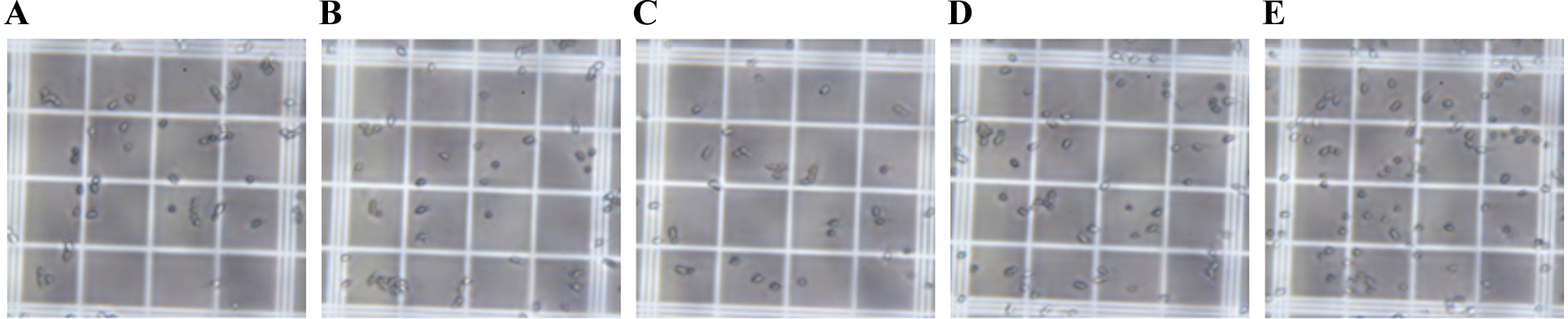
비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모내의 지방소적 형성을 관찰한 결과는 Fig. 4와 같다. 유지효모의 배양에 따라 유지효모내 지방소적이 증가하였으며, 배양에 따라 증가한 유지효모내 지방소적은 비트 열수추출물의 첨가 농도가 높아짐에 따라서 유지효모내 소량의 형광이 발현됨을 확인하였다. 0.02, 0.1 및 0.5% 비트 열수추출물은 유지효모내 지방소적을 감소시켰으며, 이는 유지효모내 생성되는 중성지방 함량을 감소시키는 비트 열수추출물의 효능을 입증하는 바이다.
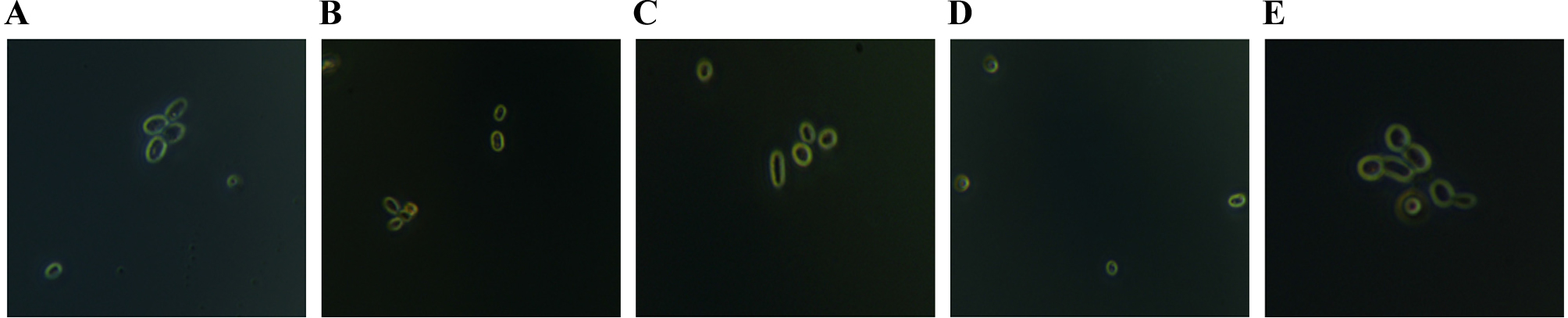
Fig. 4.
Nile Red fluorescence test of R. toruloides according to beetroot hot water extract treatment. A, R. toruloides in YPD medium without beetroot hot water extract; B, 0.02% of methionine; C, 0.02% of beetroot hot water extract; D, 0.1% of beetroot hot water extract; E, 0.5% of beetroot hot water extract.
세포수 측정
비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모의 세포수를 측정한 결과는 Fig. 5, Table 2와 같다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 세포수는 각각 6.69, 6.41, 8.12, 12.24 및 13.62×103 cell/mL로 나타났으며, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 세포수 증가율은 대조구에 비해 각각 -4, 21, 82 및 103%의 증가율을 나타내었다. 0.02% 비트 열수추출물을 첨가한 유지효모의 세포수는 대조구에 비해 유의적인 차이를 나타내지 않은 반면 0.1%와 0.5% 비트 열수추출물을 첨가한 유지효모의 세포수는 대조구에 비해 유의적으로 증가하였다.
Table 2. Cell number of R. toruloides according to beetroot hot water extract treatment
| SampleZ | Cell number (×103 cell/mL) |
| Control | 6.69±0.37b |
| Methionine | 6.41±0.77b |
| 0.02% Beet | 8.12±1.07b |
| 0.1% Beet | 12.24±2.13a |
| 0.5% Beet | 13.62±0.96a |
유리지방산의 함량 변화
비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모의 유리지방산의 함량은 Table 3과 같다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 유리지방산의 함량은 각각 1.94, 2.11, 1.87, 1.89 및2.37 ㎎/g로 나타났다. 0.02%와 0.1% 비트 열수추출물을 첨가한 유지효모의 유리지방산의 함량은 대조구에 비해 유의적인 차이가 나타나지 않은 반면 0.5% 비트 열수추출물을 첨가한 유지효모의 유리지방산의 함량은 대조구에 비해 유의적인 차이를 나타내었다. Lee et al. (2006)과 Oh (2019)의 연구에서 유지효모의 유리지방산과 중성지방의 함량의 상관성을 연구한 결과, 유지효모의 중성지방 함량이 저하되었을 경우 유리지방산을 에너지로 이용하여 유리지방산의 함량이 증가된다는 연구결과를 보고하였다. 본 연구에서 비트 열수추출물의 첨가 농도가 높아짐에 따라 유리지방산의 함량이 증가한 반면 중성지방 함량이 감소한 결과는 비트 열수추출물이 유지효모내의 중성지방을 유리지방산으로 분해하여 에너지원으로 활용한 것으로 추정되는 바이다.
Table 3. Acid value of of R. toruloides according to beetroot hot water extract treatment
| SampleZ | Acid value (%) |
| Control | 1.94±0.69b |
| Methionine | 2.11±0.01ab |
| 0.02% Beet | 1.87±0.78b |
| 0.1% Beet | 1.89±0.41b |
| 0.5% Beet | 2.37±0.40a |
총 카로티노이드 함량 분석
비트 열수추출물의 농도가 0.02, 0.1 및 0.5%가 되도록 첨가한 YPD 배지에서 배양한 유지효모의 총 카로티노이드 함량을 분석한 결과는 Fig. 6과 같다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 총 카로티노이드 함량은 각각 0.085, 0.071, 0.052, 0.087 및 0.135 ㎎/g로 나타났다. 0.02%와 0.1% 비트 열수추출물을 첨가한 유지효모의 총 카로티노이드 함량은 대조구에 비해 유의적인 차이가 나타나지 않은 반면 0.5% 비트 열수추출물을 첨가한 유지효모의 총 카로티노이드 함량은 대조구에 비해 유의적인 차이를 나타냈다. 총 카로티노이드 함량은 비트 열수추출물의 첨가 농도에 따라 농도의존적으로 증가하였다. 카로티노이드는 세포의 분화 및 증식 효과가 있다고 보고한 Wintergerst et al. (2007)과 Nagao (2009)의 연구결과로부터 비트 열수추출물이 총 카로티노이드 함량을 증가시켜 유지효모의 증식에 영향을 주는 수가 증가된 것으로 판단된다.
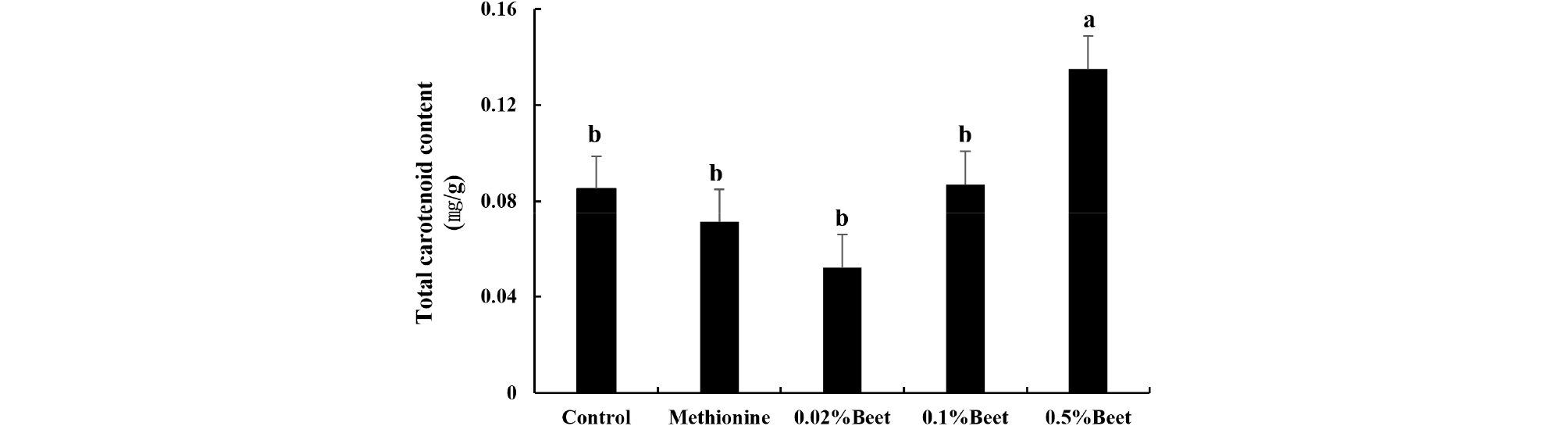
Fig. 6.
Fig. 6. Total carotenoid content of R. toruloides according to beetroot hot water extract treatment. Control, R. toruloides incubated in YPD medium without beetroot hot water extract; Methionine, R. toruloides incubated in YPD medium with 0.02% methionine; 0.02%, 0.1% and 0.5% Beet, R. toruloides incubated in YPD medium with 0.02%, 0.1% and 0.5% beetroot hot water extract, respectively. a-b) Means not sharing a common letter are significantly different among groups (p<0.05).
적 요
본 연구에서는 Rhodosporidium toruloides를 활용하여 비트 열수추출물의 중성지방 억제효과를 확인하고자 하였다. 대조구, 실험대조구, 비트 열수추출물, 30% 및 60% 에탄올 추출물을 첨가한 YPD 배지에서 배양한 유지효모의 중성지방의 함량은 각각 8.76, 3.43, 2.87, 3.16 및 3.64 ㎎/dL로 나타났으며, 유지효모의 세포수는 각각 10.48, 8.46, 12.40, 12.80 및 8.24×103 cell/mL로 나타났다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 총 지질 함량은 각각 112.29, 38.90, 147.87, 211.36 및 291.89 ㎎/g로 나타났으며, 유지효모의 중성지방의 함량은 각각 6.02, 2.83, 2.38, 1.37 및 0.73 ㎎/dL로 나타났다. 대조구, 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물의 첨가 농도가 높아짐에 따라서 유지효모내 소량의 형광이 발현됨을 확인하였다. 실험대조구, 0.02, 0.1 및 0.5% 비트 열수추출물을 첨가한 유지효모의 세포수 증가율은 대조구에 비해 각각 -4, 21, 82 및 103%로 증가하였다. 유리지방산과 총 카로티노이드 함량은 비트 열수추출물의 첨가 농도에 따라 농도의존적으로 증가하였다.