서언
재료 및 방법
식물재료 및 무균발아
신초 형성 및 생육에 미치는 생장조절제의 영향
통계처리
결과 및 고찰
Callus, somatic embryo, crown bud의 형성
신초의 형성 및 생육
뿌리의 발달과 생육
적요
서언
비비추속(Hosta) 식물은 아스파라거스과(Asparagaceae)로 분류되고 있으며(Angiosperm Phylogeny Group, 2009), 한국, 일본, 중국 등 동아시아 지역에 자생하는 특산식물이다(Grenfell, 1996; Jeong, 1985; Krause, 1930; Lee et al., 2015). 우리나라에는 좀비비추, 한라비비추, 다도해비비추, 흑산도비비추, 일월비비추, 주걱비비추 등 6종이 자생하는 것으로 알려져 있다(Chung and Chung, 1988; Chung and Kim, 1991). 이 중 좀비비추, 한라비비추, 다도해비비추, 흑산도비비추는 IUCN이 권고한 멸종위기식물 평가기준에 따라 우리나라에서만 자생하는 특산식물이며(The Korean Society of Plant Taxonomists, 2015), 특히 흑산도비비추는 산림청에서 위기종(endangerd, EN)으로 구분되고 있다(KNA, 2012).
비비추속 식물은 1800년대에 서양에 전파되어(Fujita, 1976) 정원이 발달한 유럽, 미국 등 선진국에서 오늘날까지 약 5,800개 이상의 품종을 개발하였다(AHS Hosta Registry, 2018; RHS Horticultural Database, 2018). 개발된 비비추 품종들은 식물체의 크기와 잎의 무늬, 형태, 그리고 색깔이 다양하고 여름철에 꽃을 피워 정원식물로 선호도가 매우 높다. 또한 내환경성이 뛰어나서 조경용으로 널리 이용되고 있으며, 최근에는 꽃꽂이용의 절엽 소재로도 활용되고 있다(Cho et al., 2005; Ku and Cho, 2016; Lee et al., 2003). 그러나 우리나라가 원산지임에도 불구하고 자생 비비추에 대한 연구와 품종개발 등 활용은 매우 미비한 실정이며, 외국에서 육성된 품종이 국내로 역수입되어 시장의 대부분을 차지하고 있다(Ahn et al., 2007). 국립수목원에서는 최근 자생 비비추속의 종 보전과 활용을 위한 증식 및 재배기술, 품종개발 연구를 진행하고 있다.
비비추속 식물의 증식 및 신품종 육성 등 활용을 위해서는 영양번식을 통한 대량생산이 가능해야 한다. 조직배양은 식물의 신속하고 대량의 증식뿐만 아니라 특정 종의 모계형질의 유지, 돌연변이 육종과 형질전환기술 등 다양하게 활용될 수 있다. 그 중 정단 분열조직을 이용한 조직배양은 신초를 유도하여 유식물체를 신속하고 대량으로 생산할 수 있으며, 바이러스 무병주를 증식할 수 있는 번식법이다(Spiegel, 2006; Ten Houten et al., 1968). 지금까지 조직배양에 이용된 비비추속 식물의 부위는 정단(Ku and Cho, 2016; Paek and Ma, 1996; Papachatzi et al., 1981), 미성숙 꽃눈(Meyer, 1980; Saito and Nakano, 2002), 미성숙 화서(Hill et al., 1989; Papachatzi et al., 1980), 그리고 자방(Van Tuyl et al., 1991) 등이 있다(Kim, 2011). 그러나 한국 자생 비비추의 정단 배양을 통한 기내증식에 관한 연구는 거의 이루어지지 않았다.
본 연구는 국내 자생 비비추속 식물 6종의 정단을 포함한 경정배양을 위하여 기내증식에 효과적인 cytokinin의 종류와 농도 조건을 구명하고자 하였다. 이를 통하여 기내 대량증식 체계를 확립하고 국내 자생 비비추속의 종 보전, 품종개발 등 활용을 위한 기반자료를 얻고자 하였다.
재료 및 방법
식물재료 및 무균발아
본 실험에서 사용된 비비추속 식물은 자생지에서 채종하거나 국립수목원에서 수집 및 보유하고 있던 종자를 사용하였다(Table 1). 종자는 75% ethanol로 1분, 2%로 희석한 sodium hypochlorite 용액에 20분간 진탕처리하여 표면을 소독하고 멸균수로 5회 수세하였다. 소독된 종자는 멸균된 여과지로 표면의 물기를 제거한 후에 식물생장조절제(PGRs, plant growth regulators)가 들어있지 않은 MS 기본배지(Murashige and Skoog, 1962)에서 파종하였다. 기내에서 발아한 종자는 3% sucrose와 0.2% activated charcoal을 첨가하고 pH 5.8로 조정한 MS배지로 계대배양하였다. 최소 2회 이상 계대배양을 한 식물체의 근경 부위에서 엽원기 1~2매를 포함한 정단부(shoot tip)를 2~3 ㎜ 크기로 적출하여 실험에 사용하였다. 배양실 환경은 온도 23±1℃, 습도 50±2%로 유지되었으며, 광은 40 μ㏖·m-2·s-1 PPFD로 16시간 조명하였다.
Table 1. Abbreviations and source of Hosta species used in this study
신초 형성 및 생육에 미치는 생장조절제의 영향
배지의 조제는 MS배지에 3% sucrose를 넣고 pH 5.8로 조정한 후 0.7% plant agar (Duchefa, Haarlem, Netherlands)를 첨가하였다. 제조한 배지는 121℃에서 15분간 고압 멸균하였고 멸균한 배양병(0811C, Gaooze, Suwon, Korea)에 80 ㎖씩 분주하였다. 처리구는 PGRs이 들어가지 않은 control과 0.5, 1.0, 2.0, 4.0 ㎎/L 6-benzyladenine (BA)와 0.1, 0.5, 1.0, 2.0 ㎎/L thidiazuron (TDZ)를 0.1 ㎎/L α-naphthaleneacetic acid (NAA)와 각각 혼용하여 첨가하여 처리하였다. 정단부는 배양병 당 3개체씩 치상하였고, 처리당 5병씩(총 15개체) 배양하였다. 배양 8주 후 정단 1개 당 분화되는 callus, somatic embryo, 신초 형성 및 생육 등을 조사하였다. Crown bud는 일월비비추, 주걱비비추, 다도해비비추, 흑산도비비추, 4종에서 조사하였다.
통계처리
데이터는 SAS 9.4 (SAS Institute Inc., Cary, USA)을 이용하여 분산분석(ANOVA)을 하였고, 처리간에 통계적인 유의성은 5% 유의수준에서 Duncan 다중검정을 하였다. 결과 중에서 somatic embryo, crown bud, 신초의 개수와 길이는 Sigma plot 10.0 (SPSS, Inc., Chicago, USA)을 이용하여 그래프로 작성하였다.
결과 및 고찰
Callus, somatic embryo, crown bud의 형성
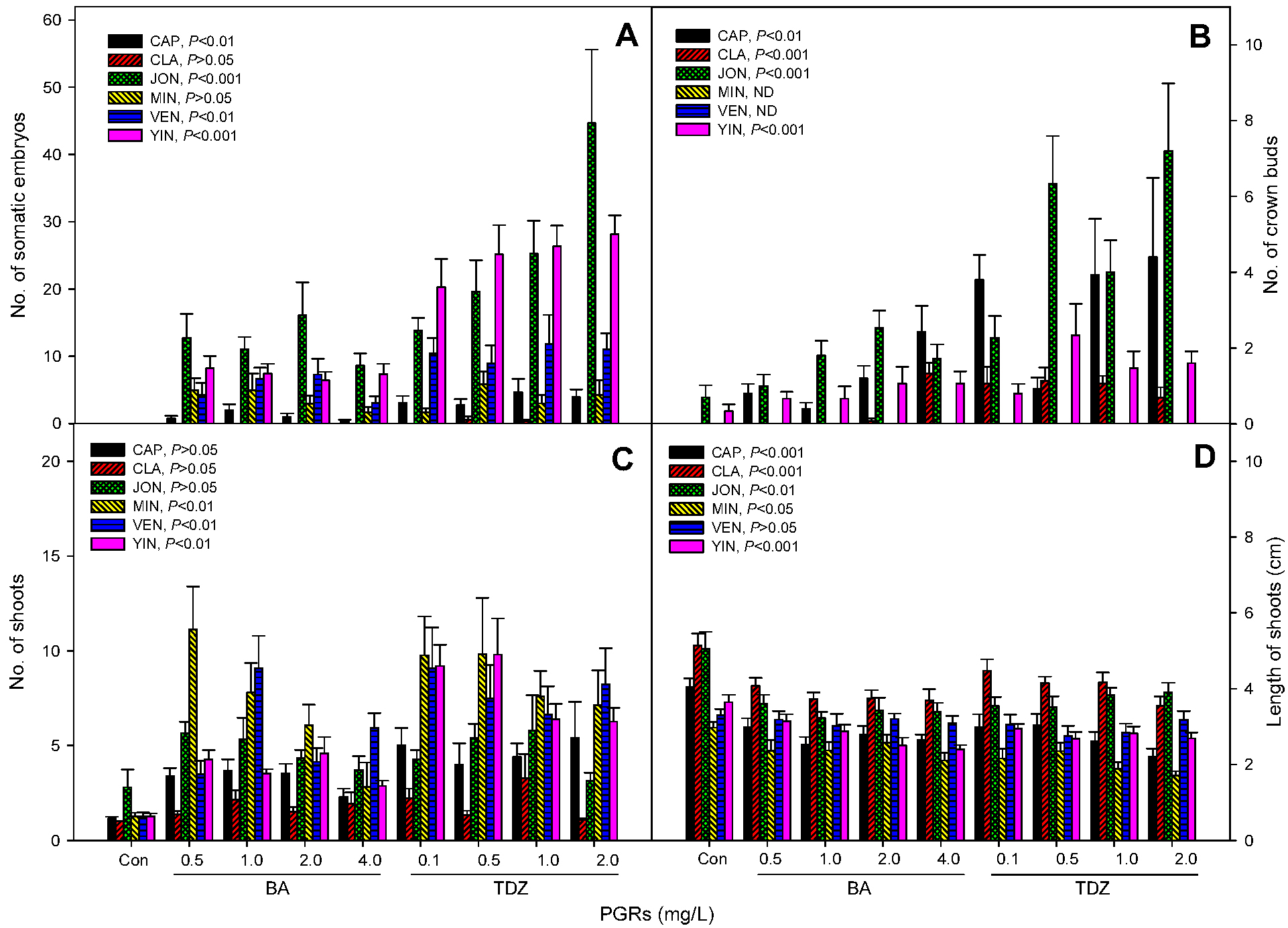
자생 비비추속 식물종에 따라 callus, somatic embryo, crown bud의 형성은 PGRs의 영향이 있으며, 그 비율과 개수에 있어서 cytokinin의 종류와 농도에 따라 차이를 보였다. 6종 모두 control에서는 전혀 callus가 형성되지 않았지만 일월비비추, 다도해비비추, 좀비비추, 한라비비추, 흑산도비비추는 PGRs 처리구에서 66.7%~100% embryogenic callus가 형성되었다(Table 2). 그러나 주걱비비추는 1.0 ㎎/L TDZ에서 20.0%가 가장 높은 형성율로서 다른 자생 비비추와 비교하여볼 때 callus 반응이 저조하였다.
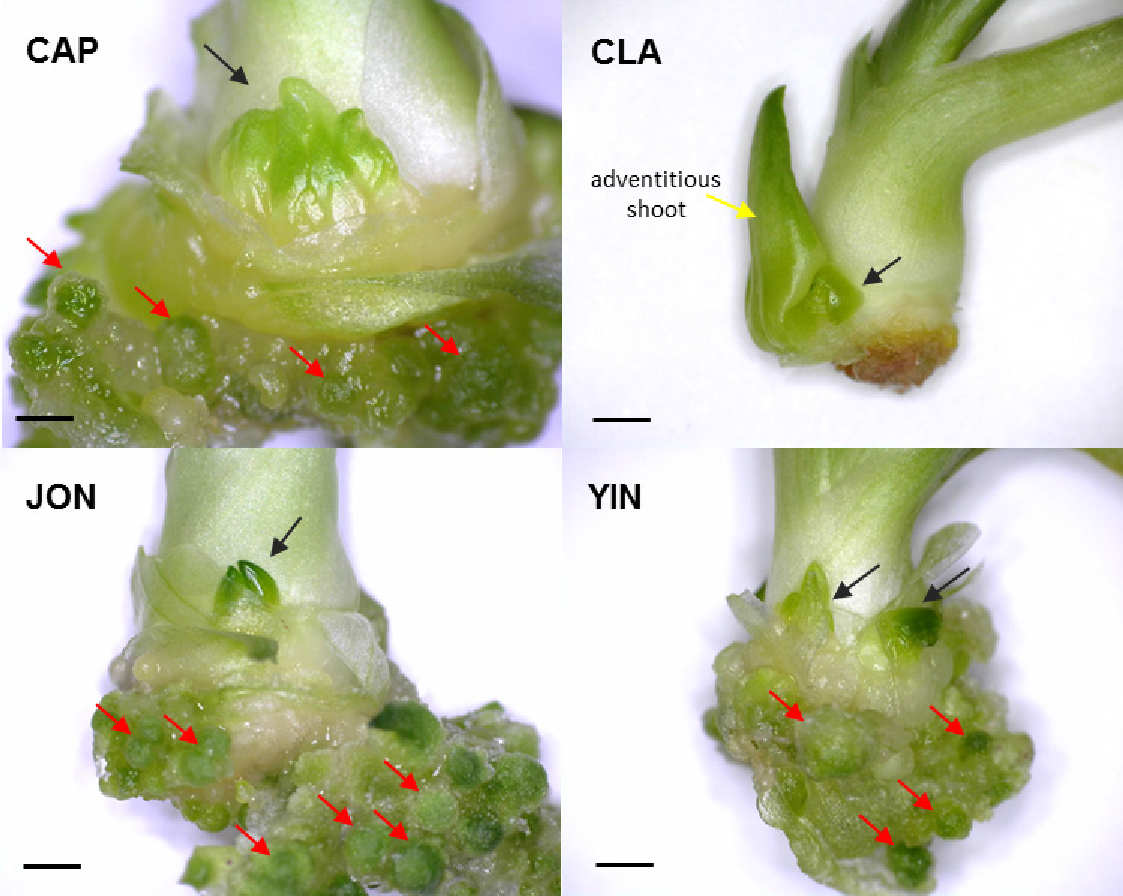
Somatic embryo 형성에서는 식물 종류에 따른 차이가 더 뚜렷하게 나타났다(Fig. 1A, Fig. 2). 일월비비추는 1.0 ㎎/L TDZ에서 4.7개, 다도해비비추는 2.0 ㎎/L TDZ에서 44.7개, 좀비비추는 0.5 ㎎/L TDZ에서 5.8개, 한라비비추는 1.0 ㎎/L TDZ에서 11.8개, 흑산도비비추는 2.0 ㎎/L TDZ에서 28.1개로 가장 높게 나타났다. 반면, 주걱비비추에서는 0.5 ㎎/L TDZ에서 0.5개이며, 나머지 처리구에서는 somatic embryo가 거의 형성되지 않았다. 다도해비비추와 흑산도비비추는 somatic embryo 형성이 다른 종에 비해 잘 되는 경향을 보였고, 흑산도비비추의 경우 cytokinin의 농도와 상관없이 BA보다 TDZ에서 더 좋은 결과를 보였다. 형성된 somatic embryo는 대부분 구형의 형태이며 그 일부가 어뢰형으로 발달하였고(data not shown), 이후 자엽으로 발달하기까지에는 8주 이상의 시간이 소요될 것으로 판단된다.
Crown bud의 경우, 조사된 4종(일월비비추, 주걱비비추, 다도해비비추, 흑산도비비추) 모두 PGRs의 처리 효과를 보였는데 일월비비추와 다도해비비추는 1.0 ㎎/L TDZ에서 각각 4.4개와 7.2개로 가장 많이 형성되었고, 주걱비비추와 흑산도비비추는 각각 4.0 ㎎/L BA에서 1.1개, 0.5 ㎎/L TDZ에서 2.3개로 앞의 2종에 비하여 적게 형성되었다(Table 2, Fig. 1B, Fig. 2).
Yang et al. (2012)은 대부분의 식물에서 같은 속의 식물이라도 아종, 유전형, 품종과 같이 다른 형태적인 차이가 있으면 같은 조건에서 배양하여도 다른 반응을 나타낸다고 하였다. 이러한 결과를 토대로 자생 비비추속 식물에 따라 somatic embryo와 crown bud 형성에서 신초로 발달시키는 증식 조건을 다르게 적용해야 할 것으로 생각된다. 한편, callus와 somatic embryo, crown bud 형성에 있어서 다른 종보다 저조한 결과를 나타낸 주걱비비추의 경우에는 더 다양한 cytokinin과 auxin의 조합과 농도 등 다른 조건에 대한 연구가 필요할 것으로 판단된다.
Table 2. Effects of different concentrations and combinations of PGRs on in vitro multiplication from shoot tip of six Hosta species after 8 weeks of culture
신초의 형성 및 생육
비비추속 식물의 정단을 기내에서 배양했을 때, 정아는 바로 생장을 시작하였고 부정아로부터 발생되는 신초는 배양 3주 이후부터 출현하기 시작하였다. 신초의 생존율은 모든 처리구에서 100%였고(data not shown), 다신초 분화율(multiple shooting rate)과 신초의 개수는 control에 비하여 PGRs 처리구에서 더 높게 나타났다(Table 2, Fig. 1C). 분화된 신초의 개수는 일월비비추는 2.0 ㎎/L TDZ에서 5.4개, 주걱비비추와 다도해비비추는 1.0 ㎎/L TDZ에서 각각 3.3개, 5.8개, 좀비비추는 0.5㎎/L BA에서 11.1개, 흑산도비비추는 0.5 ㎎/L TDZ에서 9.8개, 한라비비추는 1.0 ㎎/L BA, 0.1 ㎎/L TDZ에서 8.1개로 가장 많았다(Fig. 1C, Fig. 3).
BA는 식물의 세포분열과 분화를 유도하여 부정아와 신초 등의 발달과 생육을 촉진하는 효과가 있다고 알려져서 많은 식물의 재분화에 사용되어 왔다(Duan et al., 2006; Huh et al., 2017; Shudo, 1994). TDZ는 목본식물에서 먼저 부정아 증식에 효과가 있음이 입증되었고(Huetteman and Preece, 1993), 초본식물에서 다른 cytokinin보다 적은 농도를 사용하여도 부정아 증식과 somatic embryo 발달 등에 효과가 있다고 보고되었다(De Gyves et al., 2001; Murthy and Saxena, 1998; Yildirim and Turker, 2009). 비비추속 식물에서 H. ‘Antioch’은 2.0 ㎎/L BA처리에서, 옥잠화는 5.0 ㎎/L BA와 0.01 ㎎/L NAA에서 신초가 가장 많이 분화되었다(Paek and Ma, 1996; Papachatzi et al., 1980). 또 옥잠화 ‘조선’에서는 BA 또는 TDZ와 NAA의 혼용처리에서 비슷한 신초분화의 효과를 나타내었다(Ku and Cho, 2016). 본 연구에서는 BA뿐만 아니라 TDZ 처리 역시 신초 분화에 효과가 있었음을 확인할 수 있었다.
신초의 길이는 일월비비추, 주걱비비추, 좀비비추, 한라비비추, 흑산도비비추에서 모두 control에 비하여 PGRs 처리구에서 짧아졌으며 한라비비추는 차이가 없었다(Fig. 1D, Fig. 2, Fig. 3). 이러한 경향은 Curculigo latifolia, C. orchioides Gaertn., 그리고 Cassia sophera Linn. 등에서도 보고된 바 있는데(Babaei et al., 2014; Parveen, 2010; Thomas, 2007), 이는 cytokinin으로 인하여 신초 분화가 촉진되면서 양분이 소모되어 신초의 길이생장으로는 상대적으로 양분이 적게 공급되기 때문이라고 보여진다(Arab et al., 2014).
뿌리의 발달과 생육
뿌리의 개수와 길이가 정상적으로 발달한 control과 PGRs 처리구를 비교해보았을 때, 6종 모두 처리한 cytokinin의 농도가 높을수록 뿌리 분화율이 낮아졌고 뿌리의 수와 길이가 감소하였다(Fig. 2, Table 3). 일월비비추, 주걱비비추, 다도해비비추, 좀비비추는 TDZ의 농도가 높아질수록 아예 뿌리의 발달이 이루어지지 않았다. 이러한 결과는 몇몇의 비비추 품종과 H. sieboldiana의 선행연구에서도 유사한 결과를 보였다(Ku and Cho, 2016; Paek and Ma, 1996; Saito and Nakano, 2002). 합성옥신인 NAA는 뿌리의 발달에 작용하며 기내 발근에 많이 사용되지만 뿌리의 발달뿐만 아니라 저농도로 처리할 경우에 세포 분열과 생장에 영향을 준다고 보고하고 있다(Srivastava, 2002). 본 연구에서는 높은 비율의 cytokinin과 낮은 비율의 auxin을 혼용으로 처리하여 신초 분화를 더욱 유도하고자 처리하였다. Cytokinin과 auxin의 혼용처리에 의한 신초 형성 효과는 Curculigo orchioides (Thomas, 2007), Pinus massoniana (Zhu et al., 2010), 그리고 Embelia ribes (Annapurna and Rathore, 2010)에서 확인되었다. PGRs 처리를 통해 형성되고 분화된 신초의 생육과 뿌리 발달을 위해서는 추가적인 처리 또는 PGRs-free 배지에서 충분한 배양기간이 필요하다고 생각된다.
Table 3. Effects of different concentrations and combinations of PGRs on in vitro rooting of six Hosta species after 8 weeks of culture
결론적으로 한국 자생 비비추속 식물의 정단을 NAA와 BA또는 TDZ를 농도별로 혼용처리하여 배양하였을 때, 비비추의 종류에 따라서 embryogenic callus, somatic embryo, crown bud, 신초의 형성과 생육에 차이를 보였다. 일월비비추와 흑산도비비추는 somatic embryo, crown bud, 신초의 형성이 모두 BA보다 TDZ에서 효과적이었고, 좀비비추와 한라비비추는 somatic embryo, 신초의 형성이 BA와 TDZ의 종류와 농도에 따른 큰 차이 없이 control보다 효과적이었다. 다도해비비추는 신초의 형성은 처리구 간의 차이가 없었지만, somatic embryo, crown bud는 TDZ의 농도가 높아질수록 효과적이었다. 주걱비비추는 6종 중에서 가장 PGRs의 처리에 대한 효과가 낮았고, somatic embryo와 신초의 형성에는 처리구 간의 차이없이 분화가 잘 이루어지지 않았지만 crown bud에서는 고농도의 BA와 TDZ 처리구에서 약간의 효과를 나타내었다. 따라서 자생 비비추속의 종류에 따라 somatic embryo, crown bud 등 목표로 하는 증식재료의 유도와 형성을 위해서 적절한 PGRs의 종류와 농도를 고려한다면 기내배양을 통해 대량 증식과 육종소재 개발 등 향후 자생 비비추의 활용에 기반자료로 제공될 수 있을 것으로 기대한다.
적요
본 연구는 우리나라에 자생하고 있는 비비추속 식물 6종(일월비비추, 주걱비비추, 다도해비비추, 좀비비추, 한라비비추, 흑산도비비추)의 정단을 이용하여 대량증식과 품종개발 등을 위한 기내증식체계를 확립하고자 하였다. 정단은 0.5, 1.0, 2.0, 4.0 ㎎/L BA와 0.1, 0.5, 1.0, 2.0 ㎎/L TDZ를 0.1 ㎎/L NAA와 각각 혼용한 조건과 PGRs을 무첨가한 조건(control)의 MS배지에 배양하였다. 배양 8주 후에 embryogenic callus, somatic embryo, crown bud, 그리고 신초와 뿌리의 분화 및 생육, 생체중 등에 대하여 조사하였다. 6종의 비비추 식물 모두에서 control에 비하여 PGRs 처리구의 embryogenic callus와 somatic embryo 형성율, 다신초 분화율이 높았다. 분화된 신초의 개수는 일월비비추는 2.0 ㎎/L TDZ에서 5.4개, 주걱비비추와 다도해비비추는 1.0 ㎎/L TDZ에서 각각 3.3개, 5.8개, 좀비비추는 0.5㎎/L BA에서 11.1개, 흑산도비비추는 0.5 ㎎/L TDZ에서 9.8개, 한라비비추는 1.0 ㎎/L BA, 0.1 ㎎/L TDZ에서 8.1개로 가장 많았다. Somatic embryo 형성에서는 다도해비비추와 흑산도비비추가 처리한 PGRs에 대해 효과적이었고, 일월비비추, 주걱비비추, 좀비비추, 한라비비추에서는 상대적으로 효과가 적었다. 4종의 자생 비비추(일월비비추, 주걱비비추, 다도해비비추, 흑산도비비추)에서 조사된 crown bud도 control에 비하여 PGRs 처리구에서 더 많이 형성되었다. 주걱비비추는 cytokinin의 종류 및 농도와 상관없이 callus와 신초 분화에 큰 효과가 나타나지 않았지만, crown bud의 형성에는 TDZ에서 약간 증가하였다.