서언
재료 및 방법
염색체 배가를 위한 콜히친 처리
신초와 뿌리 발생 유도
배수성 검정
배수체의 생육 특성
결과
콜히친 처리에 의한 감 교배실생의 염색체 배가
신초 및 뿌리 발생
염색체 배가 개체의 기공 특성
고찰
적요
서언
우리나라에서 감 재배는 삼한시대 이전으로 추정되고 있으며, 대부분 떫은 감으로 홍시나 곶감으로서 이용되어 왔다. 단감은 수확기에 수상에서 떫은맛이 없어지기 때문에 따로 가공을 하지 않아도 신선감의 형태로 먹을 수 있다. 단감은 1960년대에 일본에서 도입되었으며, 주요 품종은 ‘부유’, ‘차랑’으로 이들의 재배면적이 90% 이상이다(Korea Rural Economic Institute, 2018).
우리나라의 감 산업은 단일 품종의 편중재배 심화, 신품종의 개발 및 보급 지연으로 소비가 감소함에 따라 큰 위기에 봉착해 있다. 소비자들은 맛있고 먹기에 편한 것을 추구하기 때문에 이런 소비자의 취향에 맞는 신품종의 개발 및 보급이 절실한 실정이다.
감(Diospyros kaki Thunb.)은 일반적으로 6배체 작물로 염색체의 수는 90개이나(2n=6x, x=15, Nanikawa and Higashi, 1928), 최근 일본에서 도입된 ‘Hiratanenashi’ 등 몇몇 품종은 9배체(2n=9x, intra-specific triploid)로 모두 무핵성이다(Zhuang et al., 1990). ‘Hiratanenashi’는 9배체로 나무의 세력이 강하고, 종자가 형성되지 않으며, 수량이 많고 과실의 특성이 우수하나(Yamada and Tao, 2007) 이들 품종들은 모두 떫은 감으로 탈삽 등 가공처리 과정을 거쳐야만 식용할 수 있기 때문에 우리나라에서는 재배면적의 확대가 제한적이다.
무핵 품종을 육성하는 방법의 하나로 감수분열이 발생하지 않은 2배성(2n) 화분이 발생되는 계통을 활용하기도 하는데(Sugiura et al., 2000), 2배성 화분이 발생되는 품종이 한정되어있어 목표형질을 얻기가 어렵기 때문에 교배친으로 사용할 배수체를 육성하는 것이 더욱 효과적이다.
배수체를 육성하는 방법으로는 원형질체를 융합하는 방법(Ohgawara et al., 1985), 세포분열 교란물질인 콜히친(colchicine)이나 oryzalin을 이용하여 체세포를 배수화 하는 방법(Barrett, 1974; Gmitter and Ling, 1991; Jaskani et al., 2004; Oh et al., 2015 Wu and Mooney, 2002) 등이 널리 이용되고 있다.
본 연구는 맛있고 먹기 편한 것을 추구하는 소비자들의 기호를 충족시키기 위해 콜히친을 이용한 배수체 육성기술을 개발하고, 이들 배수체를 활용하여 고품질 무핵 품종을 개발하기 위하여 수행되었다.
재료 및 방법
염색체 배가를 위한 콜히친 처리
염색체 배가를 위한 배수체 개체를 획득하기 위해 교배모본으로는 배연구소 영암포장에 식재된 ‘부유’, ‘로망’ 등 2품종을 이용하였고, 교배부본으로는 ‘태추’를 이용하였으며, 자연수분을 막기 위해 개화전에 방화곤충차단망을 설치하여 방화곤충의 유입을 차단하였다. 꽃잎이 전개되지 않은 ‘태추’품종의 수꽃을 채취하여 꽃잎을 제거하고 화분을 개약기에서 각각 12 h, 24 h 건조 후 100 ㎜ 메쉬로 걸은 후 교배에 이용하였다. 수정 후 70∼80일에 과실을 수확하여, 과실의 종자에서 배를 분리한 후 1/2 MS배지에서 배양하였다(Murashige and Skoog, 1962; Chijiwa et al., 2011). 배양 후 15일에 떡잎을 제거하고 줄기 선단의 생장점 부분을 0.5 ㎝ 길이로 절단하여 콜히친이 첨가된 한천배지에 침지하였다. 콜히친의 농도는 0.03, 0.05 및 0.1%로 3수준으로 하였으며, 처리시간은 24시간으로 하였다(Chijiwa et al., 2011). 처리 후 증류수로 콜히친을 씻어내고 호르몬이 첨가되지 않은 1/2MS 배지에서 신초와 뿌리의 발생을 유도하였다.
신초와 뿌리 발생 유도
콜히친 처리 후 신초와 뿌리의 발생을 위한 배지의 조건을 각각 구명하였다. 먼저 신초의 발생을 유도하기 위해 10 mM zeatin에 5초 동안 침지 후 호르몬이 첨가되지 않은 1/2MS 배지에 배양 및 10 μM, 30의 zeatin을 각각 호르몬이 첨가되지 않은 1/2MS 배지에 첨가 후 배양하는 등 3수준으로 처리하였다. 또한 뿌리의 발생을 유도하기 위해서는 10 mM 1-naphtalenacetic Acid (NAA)+5% Dimethyl Sulfoxide (DMSO)에 5초 동안 침지한 후 호르몬이 첨가되지 않은 1/2MS 배지 배양 및 3 μM Indolebutyric Acid (IBA) + 0.02 μM zeatin을 호르몬이 첨가되지 않은 1/2MS 배지에 첨가하여 배양하는 등 2수준으로 처리하였다(Tao et al., 1988).
배수성 검정
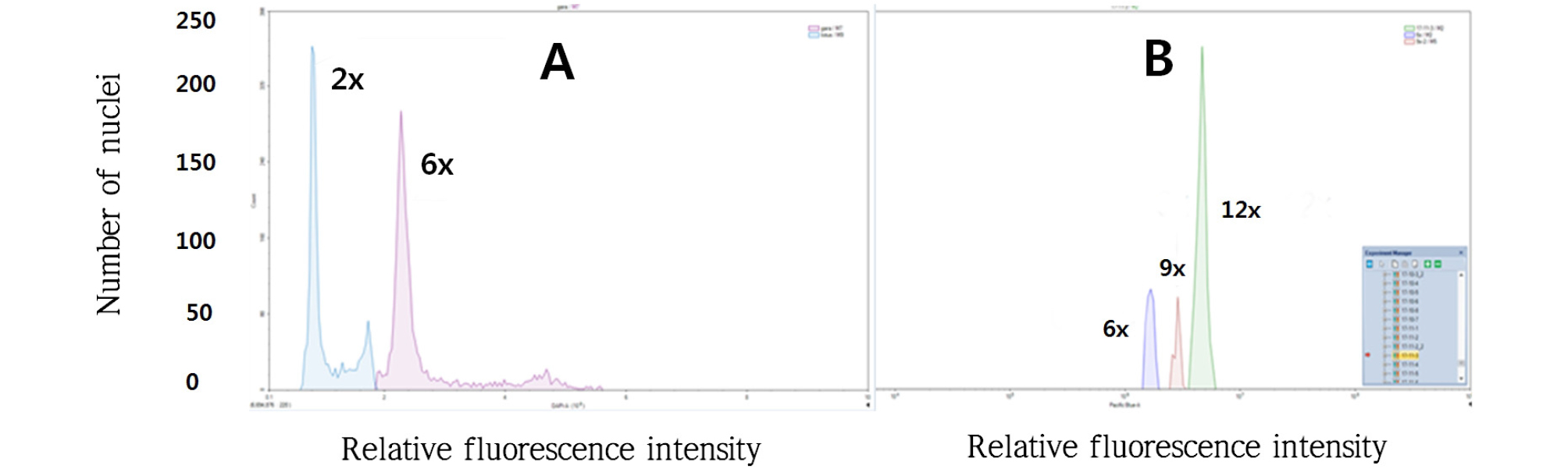
배수성 검정을 위해 콜히친을 처리한 후 신초 발생 유도용 배지에서 배양 30일 후 전개된 잎을 채취하여 0.5 ㎠의 크기로 자른 후 페트리디쉬에 놓고 400 ㎕의 핵산추출용액(CyStain® UV precise P, Extraction Buffer)을 더해 예리한 칼로 30~60초 동안 잘게 자른 후 2분 동안 배양하였다. 50 ㎛의 나일론 메쉬를 이용하여 2 ㎖의 샘플튜브에서 필터링한 후 1600 ㎕ 형광색소 용액(DAPI) (CyStain® UV precise P, Staining Buffer)을 더해 1분간 처리 후 배수성을 검정(Novocyte 2000)하였다.
배수체의 생육 특성
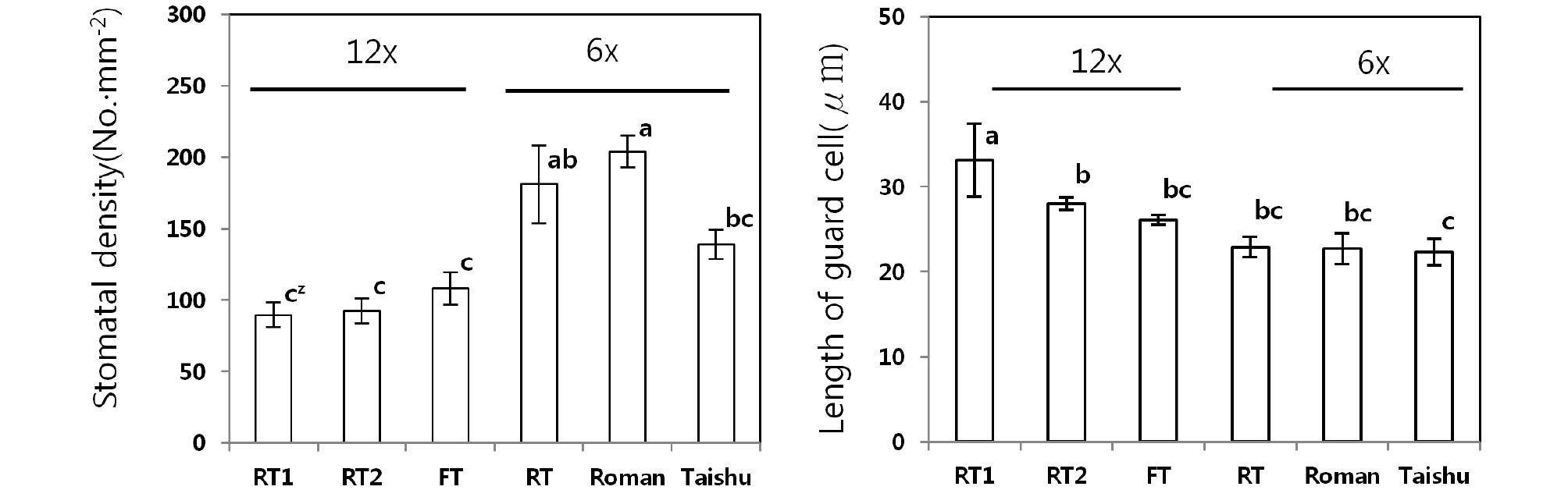
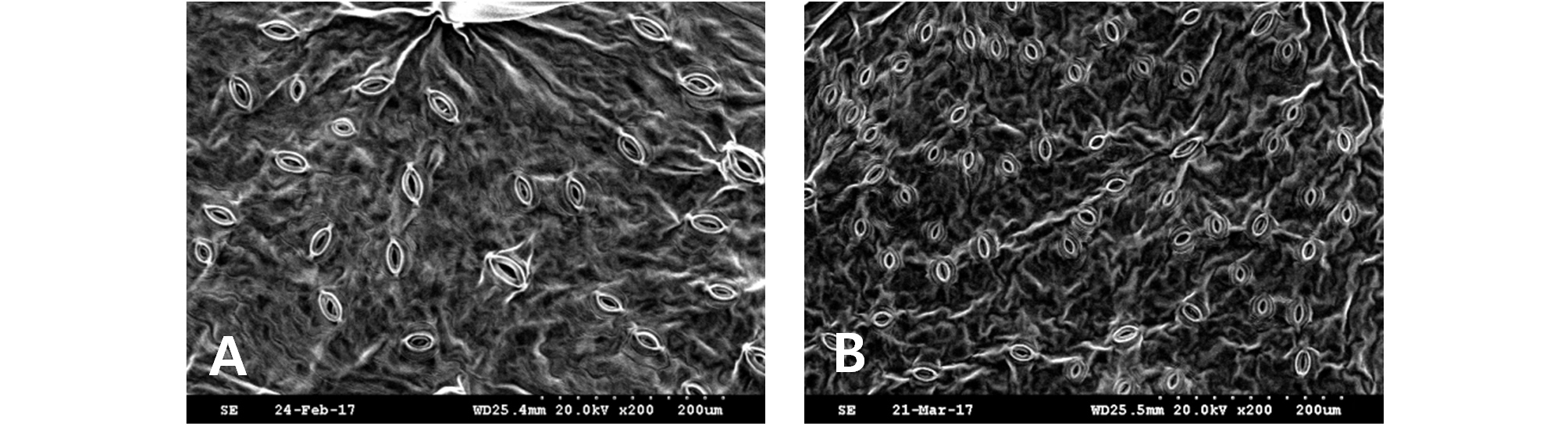
콜히친 처리로 얻어진 12배체 개체의 생육특성을 조사하기 위해 ‘부유’ב태추’, ‘로망’ב태추’의 교배조합에서 각각 12배체 개체의 잎을 5장씩 공시하여 엽면적을 측정하고, 대조로 같은 교배조합에서 배수화되지 않은 6배체 개체와 교배친 잎을 비교하였다. 기공밀도와 공변세포의 길이를 비교하기 위해 1 ㎠로 자른 잎을 증류수에 끓이고, 얼음냉수로 냉각한 후 뒷면의 표피를 벗겨내고 현미경(S-3000N, Hitechi, Japen)으로 기공밀도 및 공변세포의 길이를 측정하였다.
결과
콜히친 처리에 의한 감 교배실생의 염색체 배가
배수체 육성을 위한 교배는 ‘부유’ב태추’, ‘로망’ב태추’ 등 2개 조합에 대해 실시하였다. 총 1,013개의 교배화수에서 989개의 과실이 착과되었으며, 각각 98.4%, 97.3%의 착과율을 보였다(Table 1). 콜히친 처리 농도에 의한 감 교배실생별 염색체 배가에 미치는 영향은 Table 2와 같다.
Table 1. Fruiting numbers of cross combinations for embryo culture
| Cross Combination | No. of flower crossed (A) | No. of Fruiting (B) | No. of Fruit Drop | Rate of Fruiting (B/A*100) |
| Fuyu×Taishu | 185 | 183 | 3 | 98.4 |
| Roman×Taishu | 828 | 806 | 22 | 97.3 |
Table 2. Effect of the colchicine concentration for polyploidy and viability
ySurvival individuals was figured that it has >2 leaves after 2 month of colchicine treatment.
xPolidy was determined by flow cytometric analysis on young leaves of new shoots after colchicine treatment.
wCytochimeric plant having between hexaploid and dodecaploid.
콜히친 처리 후 농도에 따른 생존율을 조사한 결과 0.03%에서는 87.5∼97.8%의 수준이었고, 0.05%에서는 54.6∼67.21%로 비교적 높은 생존율을 보였다. 하지만 0.1%에서는 7.4∼6.7%의 매우 낮은 생존율을 보였으며, 콜히친의 농도가 높아짐에 따라 생존율이 급격히 떨어지는 것을 확인할 수 있었다. 교배조합별 생존율은 ‘부유’ב태추’ 조합보다 ‘로망’ב태추’의 교배조합에서 조금 높은 생존율을 보였다. 처리별 생존개체의 배수성의 조사는 2개의 교배조합에서 총 337개체에 대해 조사하였으며, 6x 개체는 76주, 6∼9x 개체는 36주, 12x개체는 42주였다(Fig. 1). 콜히친 농도에 따른 배수체 개체 출현 비율은 0.03%에서는 배수체(12x)가 25.0∼17.4%였고, 0.05%에서는 20.0∼19.7%였으며, 0.1%에서는 1.9%∼2.2%의 수준을 보였다. 교배조합별 배수체 개체의 출현 비율은 ‘부유’ב태추’ 조합에서 ‘로망’ב태추’의 교배조합에 비해 높은 경향을 보였다.
신초 및 뿌리 발생
콜히친 처리 후 신초 발생을 위한 배지조건을 구명하기 위해 10 mM zeatin에 순간 침지 후 1/2MS 배지에 배양하는 처리와 10 μM, 30 zeatin이 각각 첨가된 1/2MS배지에 배양하는 등 3수준으로 처리하였다(Table 3). 신초의 생육을 조사한 결과 줄기의 길이는 10 mM zeatin의 순간 침지는 1.51∼1.64 ㎝, 10 μM zeatin 배지는 2.10∼3.56 ㎝, 그리고 30 μM zeatin 배지는 2.30∼2.92 ㎝였고, 잎의 수는 10 mM zeatin의 순간 침지는 3.50∼5.21개, 10 μM zeatin 배지는 8.00∼12.3개, 그리고, 30 μM zeatin배지는 10.8∼12.3개를 보였다(Table 3, Fig. 2). 줄기의 길이와 잎의 수를 비교한 결과 10 mM zeatin의 순간 침지보다 10 μM, 30 μM zeatin이 각각 첨가 배지에서 생육이 더 좋은 것을 확인할 수 있었다. 잎의 생육도 10 mM zeatin의 순간 침지보다 10 μM, 30 μM zeatin이 각각 첨가 배지에서 생육이 더 좋은 경향을 보였다(Table 3, Fig. 2). 그리고 10 μM, 30 μM zeatin이 각각 첨가 배지에서 두 처리간 신초 및 잎의 생육을 비교한 결과 통계적 유의차이를 보이지 않았다.
Table 3. Effect of the zeatin concentration and treatment method for shoots growthz
y10 mM: Dipping in the 10 mM zeatin for 2 seconds and incubate on 1/2 MS media; 10 μM and 30 μM: Incubate at 1/2 MS media including 10 μM, 30 μM zeatin, respectively.
xDMRT at 5% level.
‘부유’ב태추’와 ‘로망’ב태추’ 교배종자의 배배양 개체에 콜히친 처리한 후 발근 조건을 구명하였다. 10 mM NAA+5% DMSO에 순간 침지한 후 1/2MS 배지 배양, 3 μM IBA+0.02 μM zeatin을 1/2MS배지에 혼합 후 배양 등 2 수준으로 처리 하였다. 처리결과 10 mM NAA+5% DMSO에 순간 침지의 경우 뿌리의 수는 2개의 교배조합에서 각각 17.0, 22.0개로 3 μM IBA+0.02 μM zeatin 배지의 2.00, 2.50개 보다 많았고, 길이는 10 mM NAA+5% DMSO에 순간 침지 5.90∼6.25 cm보다 3 μM IBA+0.02 μM zeatin 배지가 12.5∼13.5 cm로 더 길었으며, 직경은 10 mM NAA 순간 침지가 2.20∼2.58 cm로 3 μM IBA+0.02 μM zeatin 배지의 0.63∼0.68 ㎜ 보다 현저히 두꺼운 경향을 보였다(Table 4, Fig. 3). 교배조합별로는 10 mM NAA+5% DMSO에 순간 침지의 경우 ‘부유’ב태추’가 ‘로망’ב태추’보다 뿌리의 수가 많은 경향이고 뿌리의 길이와 직경에서는 차이를 보이지 않았으며, 3 μM IBA+ 0.02 μM zeatin 배지의 경우 교배조합별 차이를 보이지 않았다.
Table 4. Effect of NAA and IBA concentration and treatment method for roots growthz
y10 mM NAA+5% DMSO: dipping in the 10 mM NAA+5% DMSO for 2 seconds and incubate on 1/2MS media; 3 μM IBA+0.02 μM zeatin: Incubate at 1/2 MS media included 3 μM IBA and 0.02 μM zeatin.
xmeans ± standard error (SE).
염색체 배가 개체의 기공 특성
콜히친 처리로 얻어진 12배체와 6배체 및 6배체 교배친의 기공 특성을 조사한 결과 12배체의 평균 기공밀도는 96개・㎜-2로 6배체 181개・㎜-2와 6배체 교배친 평균 172개・㎜-2보다 적었으나 공변세포의 길이는 12배체 29.1 μm로 6배체 22.9 μm와 6배체 교배친 평균 22.5 μm보다 길었다(Fig. 4, Fig. 5).
고찰
소비자들은 맛있으면서 먹기 편한 것을 추구하고 있다. 또한 생산현장에서도 그런 소비자들의 수요를 반영하여 무핵 품종에 대한 요구가 증가하고 있다. 감에서 무핵 품종을 육성하기 위해서는 염색체를 배가하거나 미감수분열 화분을 이용하는 방법 등이 알려져 있다(Akira et al., 2000; Chitose et al., 2012; Hiroyuki et al., 2008). 미감수분열 화분을 이용하는 방법은 미감수분열 화분이 생기는 품종에 한정되어 있고, 교배후대(F1)에서 종자가 생기지 않기 때문에 F1을 이용한 교배육종에 활용할 수 없다. 한편 염색체를 배가하는 방법으로는 ‘준하’와 ‘jiro’의 원형질체 융합(Tamura et al., 1995)이 보고되어 있지만 이는 모두 재분화가 쉬운 ‘jiro’ 같은 교잡친 품종에 한정 된다(Hyroyuki et al., 2011).
In vitro에서 배아에 콜히친을 처리하면 침투성이 높아 염색체 배가 효율이 높다고 하였다(Notsuka et al., 2000). 따라서 본 시험에서도 무핵(9x) 품종을 육성하기 위한 염색체가 배가된 개체를 얻기 위해 Hiroyuki (2011) 방법을 이용하였는데, 콜히친의 농도에 따라 17.8∼36.7%의 염색체 배가 개체를 얻을 수 있었고, 콜히친의 농도가 높아지면 염색체가 배가된 개체가 많이 출현하는 경향이었으나 0.1%의 농도에서는 생존율이 떨어졌다. 따라서 배수체 유발을 위한 콜히친의 처리 농도는 생존율 및 배수체 개체의 발생률을 비교한 결과 0.05%가 가장 적합할 것으로 판단되었으며, 앞으로 더 많은 조합에서 다양한 변이의 염색체 배가 개체을 얻을 수 있을 것으로 기대된다.
In vitro에서 신초의 발생을 위한 zeatin 처리 실험에서는 10 mM zeatin에 5초 동안 침지 후 1/2MS 배지에 배양하는 것 보다 10 μM, 30 μM zeatin이 각각 첨가된 배지에서 배양하는 것이 생육이 더 좋은 경향을 보였으며, 뿌리는 10 mM NAA+5% DMSO에 5초 동안 침지한 후 1/2MS 배지에 배양하는 것이 3 μM IBA+0.02 μM zeatin이 첨가된 배지에서 배양하는 것보다 뿌리의 길이는 다소 짧았지만, 뿌리의 수와 굵기 등 전체적인 생육에서는 더 양호한 것으로 판단되었다.
최근 우리나라는 젊은 소비자들을 중심으로 먹기 편하면서 맛있는 것을 추구하는 경향이다. 우리나라에서 단감은 주로 생과로 소비되고, 떫은 감은 연시, 곶감, 반건시, 또는 감말랭이의 형태로 가공되어 소비되고 있다. 감에 씨가 없으면 생과로 먹기 편할 뿐만 아니라 가공 및 가공 후 소비도 편리해 지기 때문에 감 소비가 크게 증가될 것으로 기대된다. 현재 무핵 품종을 육성하기 위해 염색체 배가 개체를 다수 확보하였으며, 이들을 교배친으로 활용하면 새로운 염색체 조합의 다양한 변이 개체를 육성할 수 있을 것으로 기대된다.
적요
본 시험은 최근 소비트렌드의 변화에 따라 소비자들이 쉽고 편하게 먹을 수 있는 씨 없는 감 개발의 선결조건인 배수체(12x) 교배 모본을 선발하기 위해 수행되었다. 염색체가 배가된 배수체 개체를 얻기 위해 교배 종자의 배배양을 통해 얻은 유묘의 생장점에 콜히친을 처리하였다. 콜히친을 0.03, 0.05%, 0.1% 등 3수준으로 처리한 결과, 0.05%에서 염색체가 배가된 개체의 발생률이 가장 높았다. 콜히친 처리 후 우리는 신초와 뿌리의 발생을 유도하기 위한 배지 조건을 구명하는 시험을 수행하였다. 신초는 10 μM, 30 zeatin이 각각 첨가된 1/2MS배지에서 생장이 잘 되었으며, 뿌리는 10 mM NAA+5% DMSO에 5초 동안 침지 후 1/2MS배지에 배양하였을 때 생장이 잘 되었다. 또한 콜히친 처리에 의해 염색체가 배가된 개체(12x)의 기공 특성을 조사한 결과 염색체가 배가된 개체(12x)는 염색체 배가가 되지 않은 개체(6x)와 교배친(6x) 보다 잎의 공변세포 밀도는 더 적고, 크기는 더 큰 경향이었다.