서언
재료 및 방법
실험재료
시약
단일농도에서의 아세틸콜린에스테라제(AChE) 저해활성 측정
선발자원의 아세틸콜린에스테라제(AChE) 저해활성 측정
선발자원의 부티릴콜린에스테라제(BuChE) 저해활성 측정
선발자원의 UPLC-UV-MS 프로파일 분석
통계처리
결과 및 고찰
단일농도에서의 AChE 저해활성
선발자원의 AChE 저해활성
선발자원의 BuChE 저해활성
선발자원의 UPLC-UV-MS 화학성분프로파일 분석 결과
적요
서언
고령화 현상이 사회문제가 됨에 따라 노인성 질환에 관한 연구의 중요성이 강조되고 있으며, 의학 발달로 높아진 평균수명을 통해 치매는 발병률과 유병률이 점점 높아지고 있는 추세이다(Evans et al., 1989; Nordberg, 1996).
치매는 혈관성치매, 루이소체 질환, 알츠하이머 병 등을 포함하는 신경퇴행성 질환으로서 60세 이상의 치매환자 중 50∼ 60%가 알츠하이머 병(Alzheimer’s disease, AD)을 앓고 있다. 기본적인 치매 증상으로 기억력 감퇴 및 인지능력 저하가 있고, 그 중 알츠하이머 치매는 인식능력을 점차적으로 저하시키며 기억력 감퇴, 인지력 감소, 우울증 등으로 인해 일상생활 수행에 심각한 영향을 미친다(Alzheimer’s Association, 2006).
알츠하이머병은 기억과 관련된 콜린성 신경계에서 신경전달물질 중 하나인 아세틸콜린(Acetylcholine, ACh)이 관여하고 있다고 알려져 있고, 알츠하이머 환자의 뇌 신경절에서 콜린성 신경계의 퇴화는 아세틸콜린 양의 감소에 따른 결핍 현상과 기억과 연관된 해마의 구조적 이상을 만들며, 아세틸콜린 농도 감소로 아세틸콜린을 생성하는 신경세포의 손상과 아세틸콜린 분해 효소인 acetylcholinesterase(AChE) 활성의 증가로 인해 기억장애는 더욱 악화된다(Kim et al., 2005; Kasa et al., 2000).
그러므로, 근래에 아세틸콜린의 농도 감소를 늦추기 위해 AChE 저해제에 대한 연구가 진행되어 왔으며, 알츠하이머 증상을 완화시키고 병의 진전속도를 늦출 수 있는 치매치료제로 타크린(tacrine:Cognex®), 도네페즐(donepezil hydrochloride: Aricept®), 리바스티그민(rivastigmine: Exelon®), 갈란타민(galantamine:Reminyl®)이 알려져 있다(Giacobini et al., 2002). 하지만 이들 치매치료제의 사용은 메스꺼움, 식욕 부진, 구토 및 설사와 같은 부작용을 유발하여 일상 생활이 크게 개선되지 않아 보다 부작용이 적고 효과가 우수한 새로운 약물 또는 천연물 발견 등이 요구되고 있다(Lanctôt et al., 2003).
한편, 국내에서 천연식물자원의 항산화 등 활성 탐색 및 선발자원에 대한 연구(Lee et al., 2013; Lyu et al., 2007; Jang et al., 2016)는 다수 이루어져 있으나 인지기능개선과 관련하여서는 Cho et al. (2014)이 한국산 양하 꽃봉오리가 인지 기능개선 효과를 나타낸다고 보고하고 있을 뿐 식물자원의 인지능개선 효과를 탐색하고 유용 자원을 선발한 연구는 미흡하다.
따라서 본 연구팀은 천연식물자원을 대상으로 치매의 일종인 알츠하이머병을 개선 및 치료할 수 있는 소재를 발굴하기 위해 콜린성 에스테라제(AChE) 저해활성을 중심으로 탐색하였으며, 몇 가지 자원을 선발하였기에 그 결과를 보고하고자 한다.
재료 및 방법
실험재료
실험에 사용된 어저귀(Abutilon theophrasti Medicus) 열매의 물 추출물 등 184개의 식물 추출물 시료는 농촌진흥청 국립원예특작과학원 약용작물과 소속 식물분류전문가로부터 확보된 식물과 학명을 검토받아 조제된 것을 사용하였으며, 각 추출물은 아래의 방법에 따라 제조되었다(Table 1).
Table 1. Plant part extracts used for the study
ySolvents and conditions for extraction ; A, water at room temperature; B, methanol at room temperature; C, ethanol at room temperature; D, methanol at 50℃ by accelerated solvent system; E, ethanol at 50℃ by accelerated solvent system; F, ethanol at 85℃ by accelerated solvent system, G, water at 100℃; H, methanol at 74℃; I, 70% methanol at 74.
먼저, 상온에서 추출된 추출물로서 추출조건 A, B 및 C는 각각 물, 메탄올 및 에탄올로 추출 및 여과되었다. 또한, 가속용매추출장치(accelerated solvent system, Dionex ASE-350, Themofischer scientific and its subsidiaries, Sunnyvale, USA)를 이용한 추출조건 D와 E는 50℃에서 메탄올 및 에탄올로 각각 추출 및 여과되었고, 추출조건 F는 85℃에서 에탄올로 추출되었다. 그리고, 환류냉각장치를 이용한 추출방법으로 추출조건 G는 100℃에서 물로 추출된 후 여과되었으며, 추출조건 H와 I는 74℃에서 메탄올 및 70% 메탄올로 각각 추출 및 여과되었다. 여과된 각 추출물은 감압농축기(Eyela, N-1200B, Tokyo Rikakikai co. Ltd, Tokyo, Japan)를 이용하여 용매를 제거하였으며, 남은 수분 및 물 추출물은 동결건조기(PVTFD 50R, IlshinBioBase Co., Ltd., Donducheon, Korea)를 사용하여 최종 추출물을 확보하였다.
시약
실험에 사용된 sodium phosphate dibasic, sodium phosphate monobasic, acetylcholinesterase, acetylthiocholine iodide, 5,5'-dithiobis-(2-nitrobenzoic acid), sodium bicarbonate, butyrylcholinesterase, butyrylthiocholine iodide 및 tacrine hydrochloride 등의 시약은 Sigma-Aldrich Co.에서 구매하였다.
단일농도에서의 아세틸콜린에스테라제(AChE) 저해활성 측정
확보된 184개의 식물추출물의 아세틸콜린에스테라제 저해능을 100 ㎍/㎖의 단일농도에서 평가하기 위해 Ellman 방법을 변형한 Kim and Chung (2011)의 방법에 따라 실험하였다. 먼저 100 mM sodium phosphate buffer (pH 8.0)는 sodium phosphate dibasic, sodium phosphate monobasic을 각각 100 mM로 만들어 pH meter을 이용하여 pH 8.0으로 맞춰 사용하였으며, acetylcholinesterase는 10 unit 농도로 50 ㎕씩 나누어 냉동보관하면서 100 mM sodium phosphate buffer (pH 8.0) 950 ㎕를 넣어 최종 농도 0.5 U/㎖의 농도가 되게 하여 사용하였다. 또한, 기질인 75 mM acetylthiocholine iodide는 buffer (pH 8.0)에 녹여서 사용하였고, 양성대조물질인 tacrine은 0.1 ㎍/㎖ 농도로 녹여 사용하였다. DTNB 시약을 제조하기 위해 10 mM 5,5'-dithiobis-(2-nitrobenzoic acid), DTNB)와 15 mM sodium bicarbonate는 각각 100 mM sodium phosphate buffer (pH 8.0)에 녹여 1:1 비율로 혼합하였다.
최종농도를 100 ㎍/㎖이 되도록 준비한 추출물 시료와 positive control인 tacrine, control인 buffer을 각각 75 ㎕씩 96 well microplate에 분주한 후 buffer 130 ㎕, 10 mM DNTB 시약 5 ㎕, 75 mM acetylthiocholine iodide 1 ㎕를 차례대로 분주하여 상온에서 10분간 반응시키고 AChE 효소 2.5 ㎕를 분주하여 1시간 반응시킨 후 microplate reader (BIO-TEK, USA)를 이용하여 410 ㎚에서 흡광도를 측정하였고 결과는 control 군 대비 저해율(%)로 표시하였다.
Inhibition (%) = 1-(Abs/Abc)〕×100
Abs = Absorbance of tested sample after 60 min of incubation
Abc = Absorbance of control after 60 min of incubation
선발자원의 아세틸콜린에스테라제(AChE) 저해활성 측정
단일농도 실험결과로부터 선발한 7개의 추출물의 처리농도별 아세틸콜린에스테라제(AChE) 저해활성을 확인하기 위한 실험을 수행하였다. 선발시료 추출물의 최종농도가 25, 50, 100, 200 ㎍/㎖가 되도록 조제한 후 앞서 언급한 AChE 저해활성 측정방법에 준해 실험하였다.
선발자원의 부티릴콜린에스테라제(BuChE) 저해활성 측정
선발자원 7종에 대한 농도별 부티릴콜린에스테라제(BuChE)에 대한 저해활성을 확인하기 위해 앞에서 서술한 AChE 저해활성 측정방법에 준해 실험하였다. Butyrylcholinesterase (BuChE)는 10 unit농도로 50 ㎕씩 나누어 냉동보관하면서 100 mM sodium phosphate buffer (pH 8.0) 950 ㎕를 넣어 최종 농도 0.5 U/㎖로 사용하였고 buffer로 75 mM의 butyrylthiocholine iodide와 0.1 ㎍/㎖의 tacrine (positive control)을 만들어 사용하였다. 최종농도가 25, 50, 100, 200 ㎍/㎖이 되게 조제한 각 선발시료와 tacrine를 각각 75 ㎕를 96 well microplate에 분주한 후 buffer (control) 130 ㎕, DNTB 시약 5 ㎕ 및 75 mM butyrylthiocholine iodide 1 ㎕를 차례대로 분주하여 상온에서 10분간 반응시킨 후 BuChE 효소 2.5 ㎕를 분주하여 1시간 반응시키고, ELISA reader를 이용하여 410 ㎚에 흡광도를 측정하였다. 실험 결과는 AChE 저해활성 분석법과 같은 방식으로 control 대비 저해율(%)로 표시하였다.
선발자원의 UPLC-UV-MS 프로파일 분석
선발자원의 성분 프로파일을 확인하기 위해 선발시료를 UPLC (Waters Acquity™ Ultra Performance LC system, Waters Corp., Milford, USA)와 Waters Xevo G2 Q-TOF (Waters Corp., Milford, USA)를 사용하고 컬럼 (ACQUITY UPLC®BEH C18 column (2.1 ㎜×150 ㎜, 1.7 ㎛, Waters Corp., Milford, USA)을 이용하여 각 식물별로 Table 2와 Table 3에 나타낸 조건으로 분석하였다.
Table 2. UPLC analysis conditions of the selected plant extracts of sample no. 60 (Carthamus tinctorius L. fruit), sample no. 66 (Cinnamomum cassia Blume, bark), sample no. 73 (Coptis chinensis, rhizome), sample no. 129 (Nelumbo nucifera Gaertn., stamen/ovary), sample no. 140 (Persicaria tinctoria H.GROSS, flower), sample no. 144 (Phellaodendron amurense Rupr., bark, methanol ext.), and sample no. 145 (Phellaodendron amurense Rupr., bark, water ext.)
Table 3. The method of operation at mass spectrometer
| Mode | Voltage | Temperature (℃) | Gas Flow (L/h) | Range (m/z) | |||||
| Capillary (kV) | Cone (V) | Source | Desolvation | Cone | Desolvation | ||||
| Positive | 2.5 | 15 | 50 | 350 | 30 | 500 | 50-1200 | ||
통계처리
모든 실험 결과는 평균±표준편차(means±SD, n=3∼4)로 나타내었으며, Microsoft excel의 Student’s t-test에 의해 유의성을 검정하였다.
결과 및 고찰
단일농도에서의 AChE 저해활성
콜린 기능의 결손은 인지, 행동 및 일상생활활동에 영향을 미치는 알츠하이머병(Alzheimer’s disease, AD)의 발병에 관련되며, 이러한 결손에 대한 약물적 중재는 아세틸콜린에스테라제(Acetylcholinesterase, AChE) 저해에 기초하므로 확보된 식물추출물 184개를 100 ㎍/㎖의 단일농도에서 AChE 저해활성을 분석하였다(Giacobin, 2003). 실험결과, 52개의 추출물이 0% 이상의 AChE 저해활성을 나타내었으며, 나머지 132개의 시료는 음의 값을 나타내 AChE 효소에 대한 저해효과가 없었다(Table 4). 0% 이상의 AChE 저해활성을 보였던 52개의 시료 중에서는 시료번호 144 (황벽나무, Phellaodendron amurense Rupr., 수피, 메탄올 추출물), 시료번호 145 (황벽나무, Phellaodendron amurense Rupr., 수피, 물 추출물), 시료번호 129 (연꽃, Nelumbo nucifera Gaertn., 수술/자방, 메탄올 추출물), 시료번호 140 (쪽, Persicaria tinctoria H. GROSS, 꽃, 메탄올 추출물), 시료번호 73 (중국황련, Coptis chinensis, 뿌리줄기, 메탄올 추출물), 시료번호 66 (육계, Cinnamomum cassia Blume, 수피, 에탄올 추출물) 및 시료번호 60 (잇꽃, Carthamus tinctorius L., 열매, 에탄올 추출물) 등 7개의 시료는 18.7±7.8%~63.1± 1.3%의 비교적 우수한 저해활성을 보인 것을 확인하였다. 이러한 결과에 따라 단일농도에서 AChE 효소에 대해 우수한 저해활성을 보였던 7개의 시료에 대해서는 처리농도별로 추가 실험을 추진하였다.
Table 4. Inhibition effect of 184 plant extracts (at 100 ㎍/㎖) on the acetylcholinesterase activity
yFinal concentration of sample for the assay of acetylcholinesterase activity inhibition was 100 ㎍/㎖.
선발자원의 AChE 저해활성
앞에서 언급한 바와 같이 100 ㎍/㎖의 단일농도에서 우수한 AChE 저해활성을 나타내었던 7개 시료를 대상으로 최종처리농도가 25, 50, 100, 200 ㎍/㎖이 되도록 처리하여 AChE 저해활성을 분석하였으며 그 결과는 Fig. 1에 나타내었다. 실험결과를 살펴보면, 잇꽃(Carthamus tinctorius L.) 열매의 에탄올 추출물(A), 육계(Cinnamomum cassia Blume) 수피의 에탄올 추출물(B)은 처리농도에 따른 AChE 저해효과가 각각 2.6±5.2~12.8± 4.3% 및 9.1±1.3%~15.2±3.2%를 보여 전반적으로 낮은 수치를 보였다. 또한 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올 추출물(D)은 25, 50, 100, 200 ㎍/㎖의 처리농도에서 15.0±3.4%~73.5±3.6%, 쪽(Persicaria tinctoria H. GROSS) 꽃의 메탄올 추출물(E)는 19.5±9.1%~63.5±5.4%의 AChE 저해활성을 보여 처리농도가 증가함에 따라 AChE 저해활성이 유의하게 증가하는 결과를 보였다. 그리고, 중국황련(Coptis chinensis) 뿌리줄기의 메탄올 추출물(C), 황벽나무(Phellaodendron amurense Rupr.) 수피의 메탄올 추출물(F) 및 물 추출물(G)은 처리농도에 따라 각각 81.6±0.4%~58.5±2.4%, 69.9± 1.8%~80.5±0.9% 및 54.8±0.6%~78.3±2.6%의 값을 보여 처리농도에 따라 고르게 매우 높은 저해활성을 나타내는 것을 알 수 있었다.
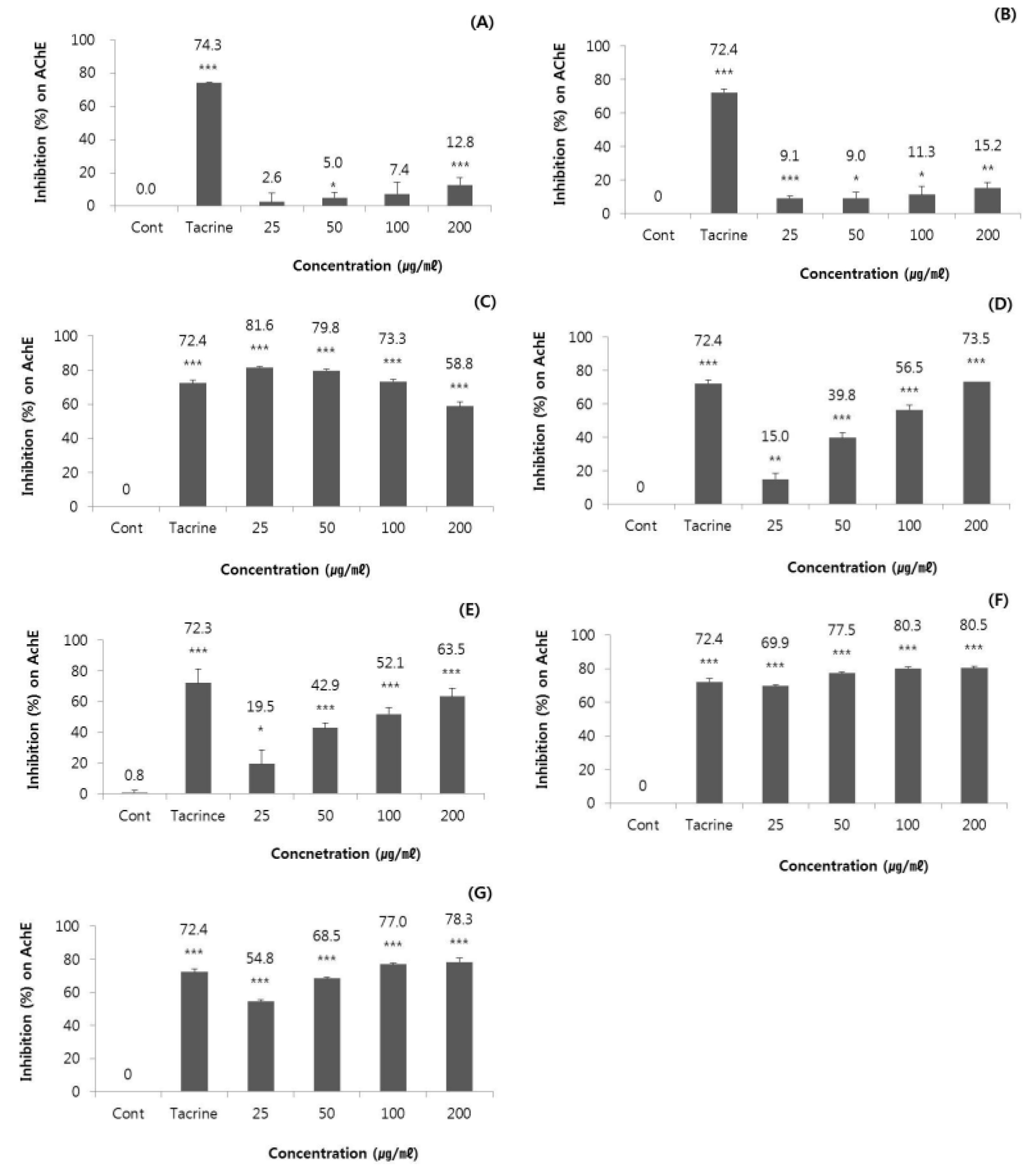
Fig. 1.
Inhibition effect of the selected plant extracts of (A) Carthamus tinctorius L. (fruit, sample no. 60), (B) Cinnamomum cassia Blume (bark, sample no. 66), (C) Coptis chinensis (rhizome, sample no. 73), (D) Nelumbo nucifera Gaertn. (stamen/ovary, sample no. 129), (E) Persicaria tinctoria H.GROSS (flower, sample no. 140), (F) Phellaodendron amurense Rupr. (bark, sample no. 144, methanol ext.), and (G) Phellaodendron amurense Rupr. (bark, sample no. 145, water ext.) on acetylcholinesterase (AChE) activity. Each extracts was experimented at the final concentration of 25, 50, 100, and 200 ㎍/㎖. Cont means control which treated with 100 mM sodium phosphate buffer (pH 8.0) and tacrine as positive control was used at the concentration of 0.1 ㎍/㎖.
Tabet (2006)에 의하면 AChE 저해제는 약~중 정도의 AD 치료에 유용하게 이용될 수 있으므로 처리농도별 AChE 저해능이 우수하였던 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올 추출물(D), 쪽(Persicaria tinctoria H. GROSS) 꽃의 메탄올 추출물(E), 중국황련(Coptis chinensis) 뿌리줄기의 메탄올 추출물(C), 황벽나무(Phellaodendron amurense Rupr.) 수피의 메탄올 추출물(F) 및 물 추출물(G)은 경증 내지 중증의 AD 치료용 소재로의 활용 가능성이 높을 것으로 사료되었다.
선발자원의 BuChE 저해활성
아세틸콜린에스테라제(AChE)와 마찬가지로 아세틸콜린의 가수분해에 관여하고 AD에서 중요한 역할을 담당하는 또 다른 콜린에스테라제(ChE)인 부티릴콜린에스테라제(BuChE)에 대한 저해활성을 확인하기 위해 단일농도에서 우수한 AChE 저해활성을 나타내었던 7개의 시료를 25, 50, 100, 200 ㎍/㎖의 최종처리농도로 실험하였다(Giobini et al., 2002). 그 결과, Fig. 2에 나타낸 바와 같이 7개의 시료 중에서 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올추출물(D), 쪽(Persicaria tinctoria H.GROSS) 꽃의 메탄올추출물(E) 및 중국황련(Coptis chinensis) 뿌리줄기의 메탄올추출물(C)이 각각 58.9±7.8~81.6±1.9% 및 45.8±9.8%~72.4±2.5% 및 33.1±9.9%~55.4±5.4%의 순으로 높은 BuChE 저해활성을 보이는 것을 알 수 있었다. 한편, 잇꽃(Carthamus tinctorius L.) 열매의 에탄올 추출물(A), 육계(Cinnamomum cassia Blume) 수피의 에탄올 추출물(B), 황벽나무(Phellaodendron amurense Rupr.) 수피의 메탄올 추출물(F) 및 물 추출물(G)은 –19.4±5.6%~12.7±12.7% 범위의 비교적 낮은 수치를 보여 BuChE에 대한 저해활성이 낮은 것으로 확인되었다.
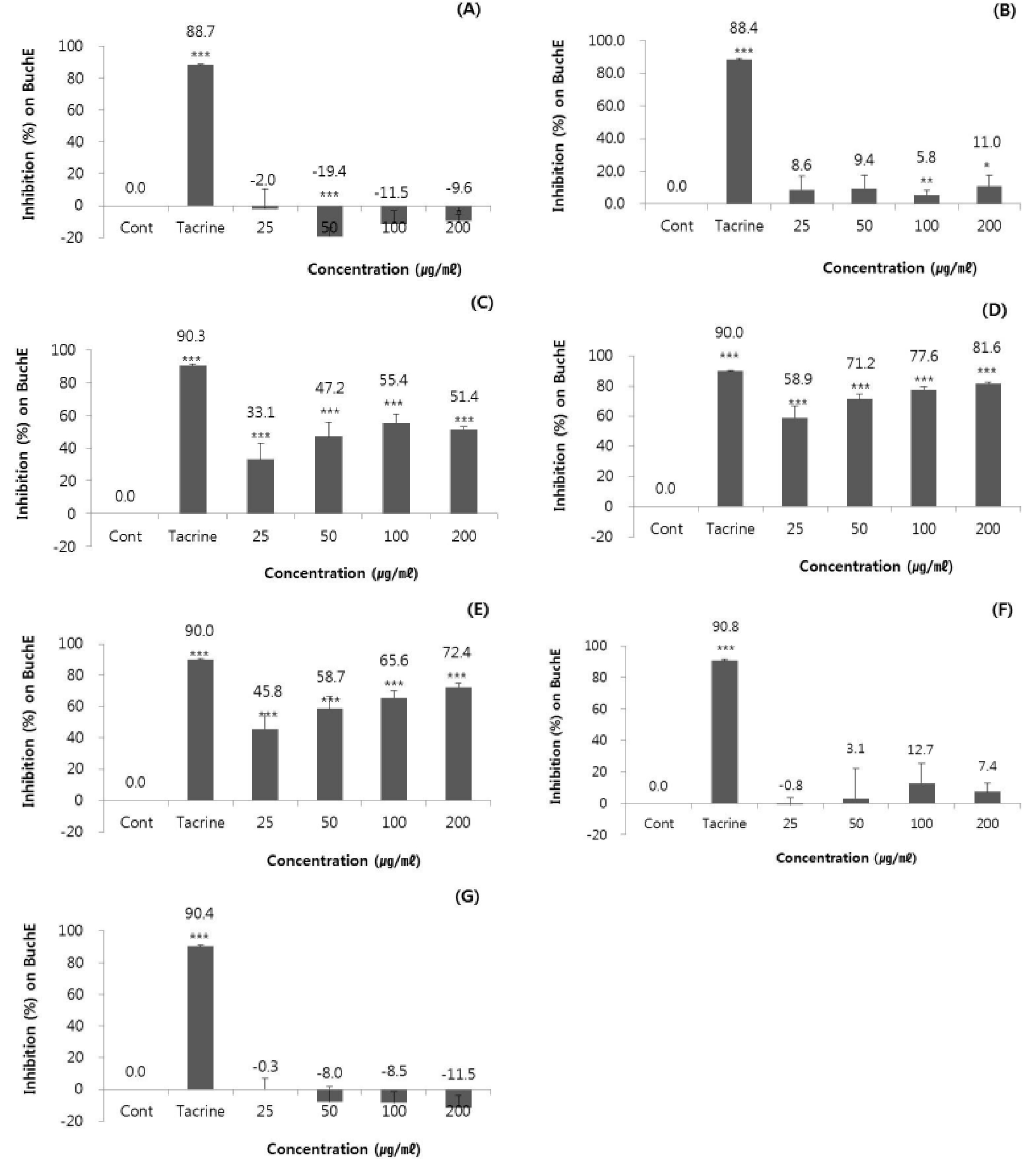
Fig. 2.
Inhibition effect of the selected plant extracts of (A) Carthamus tinctorius L. (fruit, sample no. 60), (B) Cinnamomum cassia Blume (bark, sample no. 66), (C) Coptis chinensis (rhizome, sample no. 73), (D) Nelumbo nucifera Gaertn. (stamen/ovary, sample no. 129), (E) Persicaria tinctoria H.GROSS (flower, sample no. 140), (F) Phellaodendron amurense Rupr. (bark, sample no. 144, methanol ext.), and (G) Phellaodendron amurense Rupr. (bark, sample no. 145, water ext.) on butyrylcholinesterase (BuChE) activity. Each extracts was experimented at the final concentration of 25, 50, 100, and 200 ㎍/㎖. Cont means control which treated with 100 mM sodium phosphate buffer (pH 8.0) and tacrine as positive control was used at the concentration of 0.1 ㎍/㎖.
한편, Giacobini (2003)에 의하면 심각한 AD에서는 AChE와 choline acetyltransferase (ChAT)의 90% 정도가 감소되는 반면, 부티릴콜린에스테라제(butyrylcholinesterase, BuChE)의 수준은 증가하므로 본 실험결과, 우수한 BuChE 저해효과가 확인된 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올추출물(D), 쪽(Persicaria tinctoria H. GROSS) 꽃의 메탄올추출물(E) 및 중국황련(Coptis chinensis) 뿌리줄기의 메탄올추출물(C)은 심각한 수준의 AD 치료에 이용될 수 있는 후보소재라고 사료되었다.
이상과 같이 본 실험에서는 치매와 관련하여 아세틸콜린에스테라제(AChE) 및 부티릴콜린에스테라제(BuChE) 등 콜린성 에스테라제에 대해 식물 추출물들의 저해활성을 분석하였으므로 이와 관련된 연구 보고를 살펴보고자 한다. 치매의 한 종류인 알츠하이머병(AD)은 전뇌의 콜린성 뉴런 손실과 점진적 아세틸콜린(ACh)의 감소가 특징이며, 아세틸콜린의 활성은 콜린에스테라제의 가수분해작용에 의해 종결된다. 따라서, 이들 효소에 대한 저해물질은 AD를 가진 환자에서 콜린성 뉴런의 활성을 증폭시키며, 뇌의 BuChE를 저해시키면 AD를 치료하여 인지 및 신경병리학적인 마커를 조절할 수 있다(Greig et al., 2005). 콜린계는 신경전달계로서 대뇌 피질을 조절하며 도파민, 노르에피네프린 및 글루타메이트계에 영향을 미치고, 콜린계 기능의 결손은 인지, 행동 및 일상생활 활동에 영향을 미치는 알츠하이머병(Alzheimer’s disease, AD)의 발병에 관련된다. 심각한 AD에서는 AChE와 choline acetyltransferase (ChAT)의 90%가 감소되지만, 부티릴콜린에스테라제(BuChE)의 수준은 증가한다. 그러나 베타-아밀로이드를 함유한 노인성 프라크에는 AChE와 BuChE가 함께 있고 로위체를 가진 치매에서 심각한 콜린계 손상이 발견되므로, 파키슨성 치매에 대해 AChE 저해요법이 적절할 것으로 보고되고 있다(Giacobini, 2003). 한편, AChE는 콜린성 신경말단에 존재하는 반면, BuChE는 신경교 세포나 신경단위와 관련되는 데, AChE는 정상 뇌의 측두골피질에 있는 total ChE의 90%를 구성하면서 대부분의 시냅스성 아세틸콜린의 불활성화를 매개하고 있으나, BuChE도 아세틸콜린의 가수분해에 관여하고 AD에서 중요한 역할을 담당하므로 AChE와 BuChE에 대한 저해는 AD에서 인지저하를 치료하는 데 유익할 것으로 보고되었다(Giaobini et al., 2002). 또한, AD의 발병에서 중요한 역할을 하는 Aβ의 독성은 H2O2 등의 활성산소(ROS) 증가와 관련되며, 활성산소와 H2O2는 미토콘드리아 기능에 직접 영향을 미치는 것으로 알려져 있다. 또한, 항산화제나 유리기 소거제는 Aβ에 의해 유도되는 독성에 대해 세포보호를 하며 AD 환자에서 인지결함의 정도는 ChAT 활성의 감소와 콜린성 뉴런의 손실과 유의하게 관련된다. 그러므로 활성산소 생성을 감소시키고 AChE 활성 저해를 통한 ACh의 생성을 증가시키며 ChAT 활성을 증가시키는 것은 AD 치료를 위한 중요한 전략이 될 수 있다(Ruan et al., 2010). AChE 저해제는 경중정도의 AD 치료에 유용하게 이용될 수 있으므로 대부분의 환자에게 잘 통용되며, 주요 용도는 인지저하의 안정화에 있지만 치매에서의 행동학적 정신적 증상을 개선한다. 또한, 유리기와 아밀로이드 독성에 대한 작용과 뇌와 혈액에서 활성화된 소교세포(microglia)로부터 사이토카인의 분비 감소를 통해서 AChE inhibitor의 항염 작용이 가능하다(Tabet, 2006).
이러한 보고들을 고려할 때, 본 연구에서 확인되었던 AChE에 대한 저해활성이 우수하였던 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올 추출물, 쪽(Persicaria tinctoria H. GROSS) 꽃의 메탄올 추출물, 중국황련(Coptis chinensis) 뿌리줄기의 메탄올 추출물, 황벽나무(Phellaodendron amurense Rupr.) 수피의 메탄올 추출물 및 물 추출물 등의 5가지 추출물시료는 경도부터 중간정도의 AD에서 효과를 발휘할 수 있을 것으로 예상된다. 그리고, BuChE에 대해서도 저해효과가 우수하였던 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올추출물, 쪽(Persicaria tinctoria H.GROSS) 꽃의 메탄올추출물 및 중국황련(Coptis chinensis) 뿌리줄기의 메탄올추출물 등 3개의 식물추출물은 심각한 AD에서도 개선효과를 나타낼 수 있는 소재로 확인되었으므로 활용성 검토를 위해 추가 연구가 필요하다고 사료되었다.
선발자원의 UPLC-UV-MS 화학성분프로파일 분석 결과
한편, 선발된 추출물 7개에 대한 UPLC-UV-MS 분석을 통한 화학성분 프로파일 예측을 진행한 결과를 Fig. 3 및 Fig. 4에 나타내었다. 본 실험은 기존 문헌에 보고된 개별 식물에 함유된 화학성분의 분자량 정보를 활용하여 동일 분자량을 가지는 피크들을 임의적으로 동일 화학성분으로 추정하는 방식으로 진행되었다. 시료번호 60 (잇꽃 열매의 에탄올 추출물)에 대해 분석한 UPLC-UV 크로마토그램(A)을 분석하였을 때 arachidonoylserotonin (MW 462), n-serotonin (MW 322) 및 n-feruroylserotonin (MW 352)로 추정되는 화학성분이 확인되었으며, 시료번호 66 (육계 수피의 에탄올 추출물)의 경우(B)에는 cinnamic acid (MW 148) 및 cinnamaldehyde (MW 132)가 확인되었다. 시료번호 73 (중국황련 뿌리줄기의 메탄올 추출물)의 경우(C)는 thalifendine (MW 322), jateorrhizine (MW 338), columnbammine (MW 338), coptisine (MW 320), berberine (MW 336), palmitine (MW 352)로 추정되는 화학성분이 확인되었으며, 시료번호 129 (연꽃 수술/자방의 메탄올 추출물)의 UPLC- UV 크로마토그램(D)에서는 kaempferol-6-methoxy-3-O- glucoside (MW 478), kaempferol-3-O-glucoside (MW 448), kaempferol-3-O-glucuronide (MW 462) 및 kaempferol-3- (6" malonylglucoside)-glucoside (MW 696)으로 추정되는 화학성분이 확인되었다. 또한, 시료번호 140 (쪽 꽃의 메탄올 추출물)의 UPLC-UV 크로마토그램(E)에서는 quercetin-3-O- rhamnoside (MW 448), kaempferol-3-O-rhamnoside (MW 432), quercetin-3-O-(4" malonyl) rhamnoside (MW 534), quercetin-3-O-(4" acetyl) rhamnoside (MW 490) 및 kaempferol- 3-O-(3" or 4" acetyl) rhamnoside (MW 471)로 추정되는 화학성분 확인되었고, 시료번호 144 및 145 (황벽나무 수피의 메탄올 추출물과 물 추출물의 크로마토그램인(F)와 (G)에서는 phellodendrine (MW 342), 3-O-feruloyl quinate (MW 368), menispermine (MW 356), plamtine (MW 336) 및 berberine (MW 352)이 검출되었다. 따라서, 이러한 UPLC-UV-MS 분석을 통해 각 선발식물별로 기존 문헌에서 보고된 특징적인 화학성분이 존재하는 것으로 추정되었다.
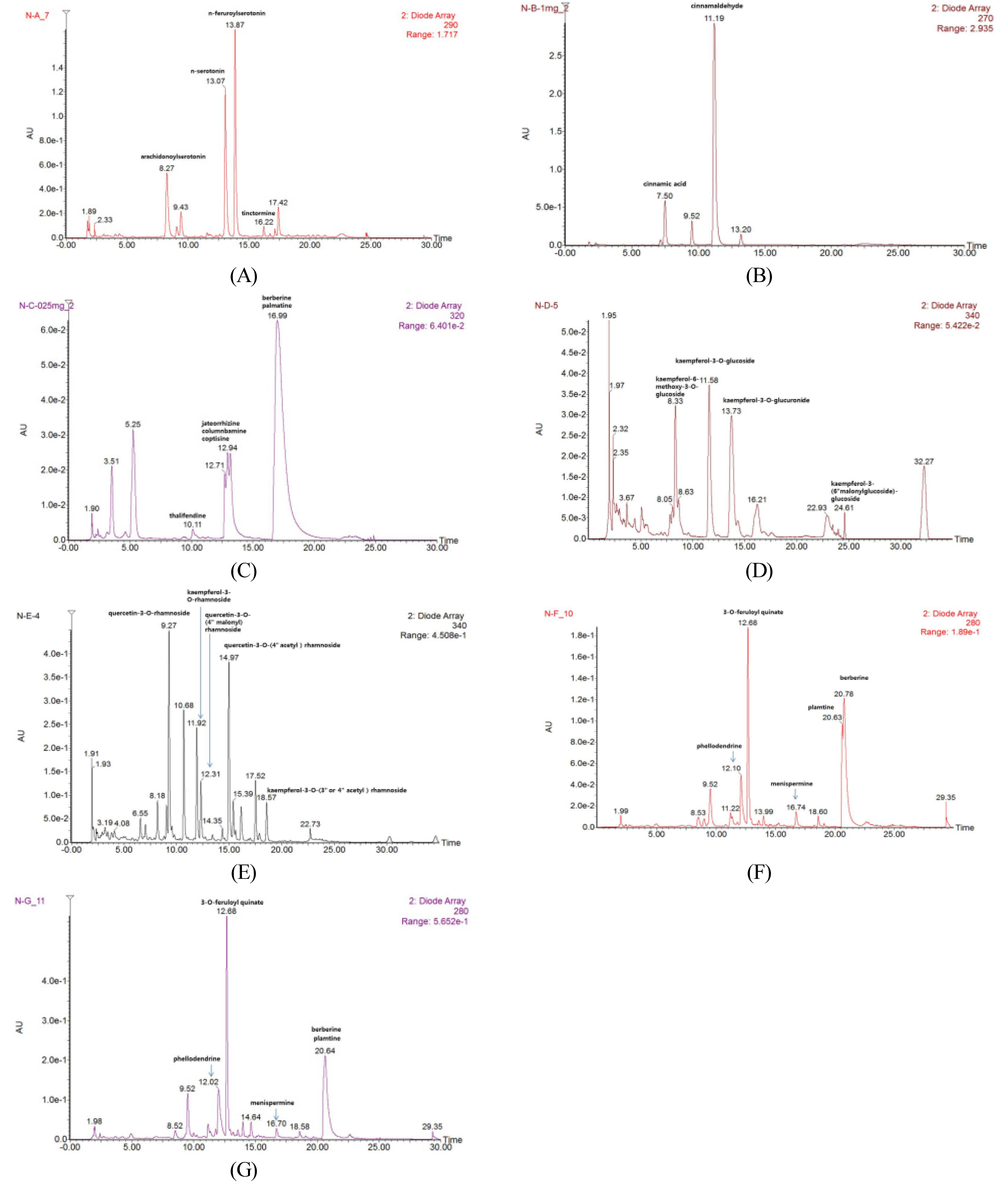
Fig. 3.
UPLC-UV chromatograms and tentative identification of metabolites obtained by UPLC-UV-MS analysis. (A) Carthamus tinctorius L. (fruit, sample no. 60), (B) Cinnamomum cassia Blume (bark, sample no. 66), (C) Coptis chinensis (rhizome, sample no. 73), (D) Nelumbo nucifera Gaertn. (stamen/ovary, sample no. 129), (E) Persicaria tinctoria H.GROSS (flower, sample no. 140), (F) Phellaodendron amurense Rupr. (bark, sample no. 144, methanol ext.), and (G) Phellaodendron amurense Rupr. (bark, sample no. 145, water ext.).
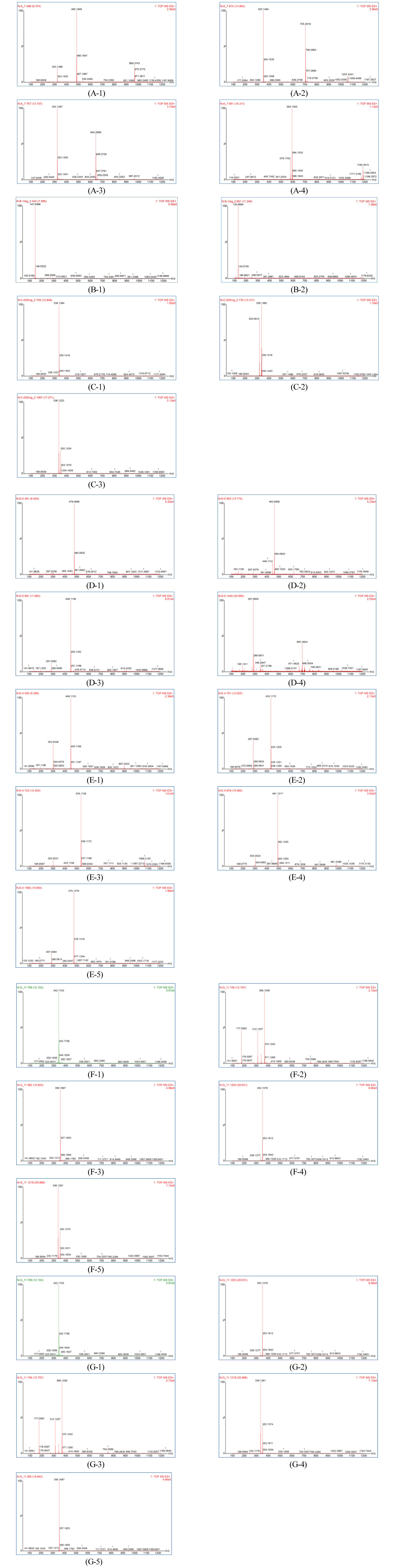
Fig. 4.
Mass spectrums of selected plant extracts. (A) Carthamus tinctorius L. (fruit, sample no. 60), (B) Cinnamomum cassia Blume (bark, sample no. 66), (C) Coptis chinensis (rhizome, sample no. 73), (D) Nelumbo nucifera Gaertn. (stamen/ovary, sample no. 129), (E) Persicaria tinctoria H.GROSS (flower, sample no. 140), (F) Phellaodendron amurense Rupr. (bark, sample no. 144, methanol ext.), and (G) Phellaodendron amurense Rupr. (bark, sample no. 145, water ext.).
적요
본 연구는 천연식물자원을 대상으로 치매의 일종인 알츠하이머병을 개선 및 치료할 수 있는 소재를 발굴하기 위해 식물추출물에 대해 콜린성 에스테라제(AChE) 저해활성을 탐색하였다. 184개의 식물추출물을 100 ㎍/㎖의 단일농도에서 아세틸콜린에스테라제(AChE)을 실험한 결과, 10% 이상의 AChE 저해활성을 보였던 추출물은 황벽나무(Phellaodendron amurense Rupr., 수피, 메탄올 추출물), 황벽나무(Phellaodendron amurense Rupr., 수피, 물 추출물), 연꽃(Nelumbo nucifera Gaertn., 수술/자방, 메탄올 추출물), 쪽(Persicaria tinctoria H. GROSS, 꽃, 메탄올 추출물), 중국황련(Coptis chinensis, 뿌리줄기, 메탄올 추출물), 육계(Cinnamomum cassia Blume, 수피, 에탄올 추출물) 및 잇꽃(Carthamus tinctorius L., 열매, 에탄올 추출물) 등 7개가 확인되었다. 선발된 7개의 추출물에 대해서는 25, 20, 100 및 200 ㎍/㎖의 최종농도에서 AChE 및 BuChE에 대한 저해활성을 검정하였다. 그 결과, AChE 저해활성에서는 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올 추출물이 15.0±3.4%~73.5±3.6%, 쪽 (Persicaria tinctoria H. GROSS) 꽃의 메탄올 추출물이 19.5±9.1%~63.5±5.4%, 중국황련(Coptis chinensis) 뿌리줄기의 메탄올 추출물이 81.6±0.4%~58.5± 2.4%, 황벽나무(Phellaodendron amurense Rupr.) 수피의 메탄올 추출물이 69.9±1.8%~80.5±0.9%, 그리고 황벽나무(Phellaodendron amurense Rupr.) 수피의 물 추출물이 54.8± 0.6%~78.3±2.6%의 값을 보였다. BuChE 저해활성에서는 연꽃(Nelumbo nucifera Gaertn.) 수술/자방의 메탄올추출물, 쪽(Persicaria tinctoria H.GROSS) 꽃의 메탄올추출물 및 중국황련(Coptis chinensis) 뿌리줄기의 메탄올추출물이 각각 58.9± 7.8~81.6±1.9% 및 45.8±9.8%~72.4±2.5% 및 33.1±9.9%~ 55.4±5.4%의 순으로 높은 BuChE 저해활성을 나타내었다. 이러한 실험결과를 종합하여 볼 때, 연꽃(Nelumbo nucifera Gaertn.)의 수술/자방, 쪽(Persicaria tinctoria H. GROSS)의 꽃, 중국황련(Coptis chinensis)의 뿌리줄기, 황벽나무(Phellaodendron amurense Rupr.)의 수피는 알츠하이머병(AD)의 개선 효과를 나타낼 수 있는 후보 소재로 사료되었다.




