서언
재료 및 방법
시료의 추출
DPPH radical 소거활성에 의한 항산화활성 검색
Xanthin oxide 억제 및 superoxide 소거활성 검색
세포 배양
Nitric oxide (NO) assay
세포독성 평가(LDH assay)
prostaglandin E2 (PGE2) 생성 억제 효능 평가
염증성 사이토카인(TNF-α, IL-6, IL-1β) 생성 억제 효능 평가
Western blot analysis
통계분석
결과 및 고찰
DPPH radical 소거활성에 의한 항산화 활성 검색
Xanthine oxidase 억제
superoxide 소거 활성
세포 독성에 미치는 영향
Nitric oxide 생성억제 효과
Pro-inflammatory cytokine 생성 억제 효과
Prostagladin E2 (PGE2) 생성에 미치는 영향
iNOS 생성에 미치는 영향
COX-2 발현에 미치는 영향
적 요
서 언
생체 내 항산화 시스템은 외부의 산화적 스트레스로부터 야기되는 여러 가지 질환을 억제함으로서 인체를 보호하지만, 산화적 스트레스를 완전하게 방어할 수는 없기에 이를 보완 및 대체할 수 있는 항산화 소제 연구가 꾸준하게 이루어지고 있다(Carocho and Ferreira, 2013; Jang et al., 2016; Sim et al., 2017). 특히, 인체는 물질의 대사 및 에너지 생산을 위하여 필수적으로 산소를 이용하고 있으며 정상적으로는 물과 이산화탄소를 배출한다. 그러나 이중 약 4% 가량은 완전히 환원되지 못하여 반응성이 강하고 유해한 활성산소가 된다(Halliwell and Gutteridge, 1993). 유해산소로 알려져 있는 활성산소는 노화나 암 등의 여러 가지 성인병의 원인이 되고 있다(Talalay and Benson, 1982; Wefers et al., 1984; Bae, 2002).
최근에 노화 및 성인병 질환의 원인이 활성 산소종에 기인된 것이라는 연구가 보고됨에 따라 이를 조절하거나 제거할 수 있는 항산화제에 대한 연구가 활발히 진행되어 많은 항산화제의 개발연구가 보고되고 있다(Corl, 1974; Coleman et al., 2003). 그러나, 현재 BHA (butylated hydroxyanisole) 및 BHT (butylated hydroxytoluene)와 같은 합성 항산화제는 효과가 우수하고 경제성 때문에 많이 이용되고 있지만 생체 효소, 지방의 변이 및 독성으로 인해 인체에 암을 유발할 수 있다는 안전성 문제로 phenolics, flavonoids, carotenoids 등과 같은 천연 항산화제의 개발이 요구되고 있다(Branen, 1975; Williams et al., 1990)
염증은 외부 자극에 대한 생체 조직의 방어반응의 하나로서 손상된 조직을 재생하려는 기작이다. 그러나 지속적인 염증반응은 만성염증질환 및 종양 등의 유발 원인이 되기도 한다(Ismaki and Punnonen, 1997). 염증반응에 관여하는 대표적인 세포 중 하나인 대식세포는 염증성 매개물질인 interleukin (IL)-6, IL-1β, tumor necrosis factor-α (TNF-α) 등과 같은 pro-inflammatory cytokine과 nitric oxide (NO), inducible nitric oxide synthase (iNOS), PGE2 등의 염증유발인자들을 생성한다(Storck et al.,1994). 염증반응의 지표물질인 NO는 L-arginine에서 NO synthase (NOS)에 의해 합성된다. NOS에는 endothelial NOS, neuronal NOS, inducible NOS (iNOS)의 세 가지 형태가 있으며, 이들 중 iNOS에 의한 NO 생성은 병리학적으로 중요한 역할을 한다(Nathan, 1992). 일반적인 NO의 형성은 박테리아를 죽이거나 종양을 제거하는 면역반응의 역할을 한다(Moncada et al., 1991). 그러나 lipopolysaccharide (LPS) 또는 염증성 cytokine 등에 의해 발현이 유도된 iNOS에 의한 과다한 NO 생성은 염증 반응을 심화시켜 조직의 손상, 유전자 변이 및 신경손상 등을 일으키는 것으로 알려져 있다(Stuehr et al.,1991; McCartney et al.,1993; Weisz et al.,1996; Yun et al.,1996).
좁은잎천선과나무(Ficus erecta var. sieboldii (Miq.) King)는 무화과속에 속하는 식물로서 젖꼭지나무, 가는잎천선과 등의 이명을 가지며, 우리나라에서도 제주도와 남해안 지방 특히 제주도에 주로 자생하는 식물이다. 바닷가 산기슭에서 자라며 높이는 2∼4 m 정도로 자라는 낙엽 관목으로 수피는 평활하며 가지는 회백색이고 털이 없으며, 잎은 오생하며 피침형이고, 길이는 3.5∼20 ㎝로서 가장가리가 밋밋하나 맹아에 톱니가 있으며 양면에 털이 없으나 표면에 털이 약간 있는 것도 있고 엽맥이 뚜렷하게 돌출하며 엽병은 길이가 1∼3 ㎝이다(Lee, 1980). 민간에서는 오래전부터 보중, 익기, 건비, 화습, 강근장골, 소종, 활혈, 해독의 효능이 있으며, 류마티스성 관절염, 중기허약, 기혈쇠미, 사디산언, 근골불리, 타박상, 경폐, 산후유즙결핍을 치료 등에 이용되어져 왔으나(Ahn, 1998), 생리활성 보고가 이루어지지 않아 본 연구에서는 좁은잎천선과나무 알코올 추출물의 항산화 및 항염증 효과를 탐색함으로써 향후 식의약품 소재 등 천연물 소재로의 활용 가능성에 대해 알아보고자 하였다.
재료 및 방법
시료의 추출
본 연구에 사용한 좁은잎천선과나무는 서귀포시 남원읍에서 채취하였으며, 제주생물종다양성연구소의 송관필 박사의 식물학적 동정을 거쳤으며, 실험에 사용한 시료의 확증표본(표본번호 JBRI-20100624019)은 제주생물종다양성연구소 표본실에 보관하고 있다.
좁은잎천선과나무의 잎은 수세 후 열풍건조 한 다음 마쇄기로 갈아 분말화 하였다. 분말시료 300 g을 70% 발효주정(EtOH)으로 1회 교반 추출 후 여과하여 감압 농축하여 용매를 증발시켰다. 여기에서 얻은 EtOH 추출물(90 g)을 계통적 추출 방법에 의하여 n-hexane (Hex) 분획(2.73 g), dichloromethane (CH2Cl2) 분획(1.24 g), ethylacetate (EtOAc) 분획(0.49 g), n-buthanol (BuOH) 분획(7.32 g) 및 water 분획(70.01 g)을 얻어 실험시료로 사용하였다.
DPPH radical 소거활성에 의한 항산화활성 검색
항산화활성은 1,1-diphenyl-2-picrylhydrazyl (DPPH, Sigma)를 이용하여 시료의 라디칼 소거효과(radical scavenging effect)를 측정하는 Blois법을 활용하였다(Blois, 1958). DPPH 약 2 ㎎을 EtOH 15 ㎖에 녹여 DPPH용액을 제조하였다. 이 용액 12 ㎖에 DMSO 6.25 ㎖를 첨가한 후, 517 ㎚의 파장에서 대조군의 흡광도가 0.94~0.97이 되도록 EtOH로 희석하여 10초간 진탕시켰다. 그리고 용매 1 ㎖에 분말로 추출된 시료 1 ㎎을 섞은 후 충분히 녹이고, 준비된 DPPH 450 ㎕에 시료용액 50 ㎕를 넣어 섞은 후 실온에서 10분간 방치하였다가 517 ㎚에서 흡광도를 측정하였다.
Xanthin oxide 억제 및 superoxide 소거활성 검색
Xantin/xanthine oxidase에 의한 uric acid 생성은 290 ㎚에서 증가된 흡광도에 의해 측정하였고, superoxide의 양은 nitroblue tetrazolium (NBT) 환원방법에 의해 측정하였다(Fridovich, 1970; Nishikimi et al., 1972). 반응액으로는 각 농도별 시료(15.63, 31.25, 62.5, 125, 250, 500, 1000 ㎍/㎖)와 0.5 mM xanthin과 1 mM EDTA를 200 mM phosphate buffer (pH 7.5) 100 ㎕에서 준비하였고, 50 mU/㎖ xanthin oxidase를 첨가하여 uric acid의 생성을 유도하였다. Superoxide 소거활성은 위 반응액에 0.5 mM NBT를 첨가하여 반응시켰다. Xanthine oxidase 억제 및 superoxide 소거활성은 각각 생성된 uric acid와 superoxide의 흡광도가 50% 감소할 때 나타나는 시료의 농도(IC50)로 표시하였으며, 각 시료는 3회 반복하여 실험을 실시하여 평균값을 구하였다.
세포 배양
Murine macrophage cell line RAW 264.7 세포를 KCLB (Korean Cell Line Bank)로부터 분양 받아 100 units/㎖ penicilin-streptomycin과 10% fetal bovine serum (FBS)이 함유된 DMEM 배지를 사용하여 37℃, 5% CO2항온기에서 배양하였으며, 3∼4일에 한번씩 계대배양을 시행하였다. Lipopolysaccharide (LPS, E. coli serotype 0111:B4)를 Sigma로부터 구입하여 사용하였다.
Nitric oxide (NO) assay
RAW 264.7 세포(1.5 ✕ 105 cells/㎖)를 DMEM 배지를 이용하여 24 well plate에 접종하고, 시험물질과 LPS (1 ㎍/㎖)를 함유한 새로운 배지를 동시에 처리하여 24시간 배양하였다. 생성된 NO의 양을 Griess 시약을 이용하여 세포배양액 중에 존재하는 NO2-의 형태로 측정하였다. 세포배양 상등액 100 ㎕와 Griess시약 [1% (w/v) sulfani-lamide, 0.1% (w/v) naphylethylenediamine in 2.5% (v/v) phosphoric acid] 100 ㎕를 혼합하여 96 well plate에서 10분 동안 반응시킨 후 ELISA reader를 이용하여 540 ㎚에서 흡광도를 측정하였다. 표준농도 곡선은 sodium nitrite (NaNO2)를 serial dilution(연속희석)하여 얻었다.
세포독성 평가(LDH assay)
RAW 264.7 세포(1.5 ✕ 105 cells/㎖를 DMEM 배지에 시험 약물과 LPS (1 ㎍/㎖)를 동시에 처리하여 24시간 배양 한 후 배양 배지를 얻어 3,000 rpm에서 5분간 원심분리 하였다. LDH (lactate dehydrogenase) 활성을 non-radioactive cytotoxicity assay kit (Progma, USA)를 이용하여 측정했으며, 96 well plate에 원심분리하여 얻은 배양 배지 50 ㎕와 reconstituted substrate mix를 50 ㎕를 넣고, 실온에서 30분 반응시킨 후 50 ㎕의 stop solution을 넣어 490 ㎚에서 흡광도를 측정하였다. 각 시료군에 대한 평균 흡광도 값을 구하였으며, 대조군(LDH control, 1:5000)의 흡광도 값과 비교하여 세포독성을 평가하였다.
prostaglandin E2 (PGE2) 생성 억제 효능 평가
RAW 264.7 세포를 DMEM 배지를 이용하여 1.5 ✕ 105 cells/㎖로 조절한 후 24 well plate에 접종하고, 5% CO2 항온기에서 18시간 전배양 하였다. 이후 배지를 제거하고 10배 농도(1 ㎎/㎖)로 조제된 시험물질 50 ㎕와 450 ㎕의 LPS 최종농도(1 ㎍/㎖)를 함유한 새로운 배지를 동시에 처리하여 전배양과 동일한 조건에서 배양하였다. 24시간 후 Prostaglandin E2 (PGE2)를 측정하기 위해 배양 배지를 12,000 rpm에서 3 min간 원심분리 하여 상층액을 얻었다. PGE2의 정량은 PGE2 ELISA kit (R&D System, Inc, USA)를 이용하여 정량하였으며 standard에 대한 표준곡선의 r2 값은 0.99 이상이었다.
염증성 사이토카인(TNF-α, IL-6, IL-1β) 생성 억제 효능 평가
RAW 264.7 세포를 DMEM 배지를 이용하여 1.5 ✕ 105 cells/㎖로 조절한 후 24 well plate에 접종하고, 5% CO2 항온기에서 18시간 전배양 하였다. 이 후 배지를 제거하고 RAW 264.7 세포는 10배 농도(5, 10, 20 ㎍/㎖)로 조제된 추출물 시료 50 ㎕와 450 ㎕의 LPS (1 ㎍/㎖)를 함유한 새로운 배지를 동시에 처리하였고 전배양과 동일한 조건에서 배양하였다. 24 시간 후 배양 배지를 원심분리(12,000 rpm, 3 min)하여 얻어진 상층액의 pro-inflammatory cytokines 생성 함량을 측정하였다. 모든 시료는 정량 전까지 –20℃ 이하에 보관하였다. pro-inflammatory cytokines 정량은 mouse enzyme-linked immnunosorbent assay (ELISA) kit (R&D System Inc., Minneapolis, MN, USA)를 이용하여 정량하였으며 standard에 대한 표준곡선의 r2값은 0.99 이상이었다.
Western blot analysis
RAW 264.7 세포 (1.0 ✕ 106 cells/㎖)를 18시간 전 배양을 하고, LPS (1 ㎍/㎖)로 자극을 주고 시료(50 ㎍/㎖)를 동시에 처리하여 전 배양과 동일 조건에서 24시간 동안 배양하였다. 배양이 끝난 후, 세포를 2~3회 PBS (Phosphate Buffered Saline)로 세척 후 300 ㎕의 lysis buffer를 첨가, 30분~1시간 동안 lysis 시킨 후 원심분리(15,000 rpm, 15 min)하여 세포막 성분 등을 제거하였다. 단백질 농도는 BSA (bovine serum albumin)을 표준화하여 Bio-Rad Protein Assay Kit를 사용하여 정량 하였다. 20~30 ㎍의 lysate를 8% mini gell SDS-PAGE (poly acrylamide gel electrophoresis)로 변성 분리하여, 이를 PVDF membrane (BIORAD)에 200 ㎃로 2시간 동안 transfer하였다. 그리고 membrane의 blocking은 5% skin milk가 함유된 TTBS (TBS+0.1% Tween 20)용액에서 상온에서 2시간 동안 실시하였다. iNOS와 COX-2의 발현 양을 측정하기 위해 1차 항체로서 anti-mouse iNOS (Calbiochem)와 anti-goat COX-2 (BD Biosciences)를 TTBS용액에서 희석(1:1000)하여 상온에서 2시간 반응시킨 후 TTBS로 3회 세정하였다. 2차 항체로는 HRP (horse radish peroxidase)가 결합된 anti-mouse IgG와 anti- goat IgG (Amersham Co.)를 1:5000으로 희석하여 상온에서 30분간 반응시킨 후, TTBS로 4회 세정하여 ECL 기질(Amersham Co.)과 1분간 반응 후 X-ray 필름에 감광하였다.
통계분석
실험결과는 SAS Program (statistical analysis system)을 이용하여 분석하였고, 평균치와 표준편차로 나타냈다. 그룹간의 유의적인 통계차를 분석하기 위하여 p<0.05의 유의 수준에서 Duncan's multiple range test를 실시하였다.
결과 및 고찰
DPPH radical 소거활성에 의한 항산화 활성 검색
항산화 물질의 가장 특징적인 기작은 유리기와 반응하는 것으로 유리기 소거 작용은 활성라디칼(free radical)에 전자를 공여하여 식물 중의 항산화 효과나 인체에서 노화를 억제하는 척도로 사용된다. DPPH는 안정한 유리기로 cysteine, glutathione과 같은 황함유 아미노산과 ascorbic acid, aromatic amine (ρ- phenylenediamine, ρ-aminophenol) 등에 의해 환원되어 탈색되므로 항산화 물질의 항산화능 측정에 많이 이용되고 있다(Chang et al., 1998). 좁은잎천선과 잎의 조추출물과 각각의 유기용매 분획물의 실험 결과 높은 라디칼 소거 활성을 보이지는 않았으나, EtOAc 분획물의 라디칼 소거 활성에 대한 IC50 값은 75.02 ㎍/㎖로 나타났다(Table 1).
Table 1. Comparison of antioxidant potential on 70% EtOH extract and solvent fractions of FES
Xanthine oxidase 억제
Xanthine oxidase는 산화적 환경에서 xanthine dehydrogenase로부터 생성된다. Xanthine oxidase는 hypoxanthine을 산화시켜 최종적으로 uric acid와 산소를 생성하며 산소유리기와 수소과산화기가 이 산소로부터 발생하게 된다. Uric acid의 축적은 고요산혈증과 통풍을 유발시키며 uric acid 형성의 억제제가 이들 질환을 위한 치료 물질로서 유용할 것이다. 게다가 xanthine oxidase에 의해 생성된 산소유리기는 세포의 손상을 초래한다(Chang et al., 1998). 좁은잎천선과 잎 조추출물과 각각의 유기용매분획물의 xanthin oxidase 활성 억제에 대한 결과는 일반적으로 항산화제로 활용되는 타 식물보다는 낮은 활성을 보이고 있다. 좁은잎천선과나무 EtOAc 분획물에서 xanthin oxidase 활성 억제는 IC50 값이 422.69 ㎍/㎖로 가장 높게 나타났다(Table 1).
superoxide 소거 활성
정상적인 산화적 인산화의 과정동안 소모되는 전체 산소의 0.4-4% 정도는 free radical superoxide (·O2-)로 전환되며 생성된 ·O2-는 다른 reactive oxygen species (ROS)로 전환되어 직접적 또는 간접적으로 세포손상을 유발하는 것으로 알려져 있다. 정상적으로는 ·O2-는 내인성 항산화 방어기전에 의해 superoxide dismutase (SOD)에 의해 빠르게 과산화수소로 전환된다. 그러나 이 내인성 항산화 방어체계가 세포내 산화-환원 균형을 유지하는데 문제가 생길 경우 결과적으로 산화스트레스가 일어나게 되며 이 산화스트레스는 직접적으로 세포내 거대분자의 손상을 일으키거나 세포손상을 일으키는데 중요한 역할을 한다(Korycka et al., 1979). 따라서 산소 유리기의 자유기를 소거할 수 있는 물질 또한 산화적 손상의 예방에 유용할 것으로 사료된다. 좁은잎천선과나무 잎 조추출물과 분획물에 대한 superoxide 소거활성의 대한 결과는 DPPH radical 소거활성 및 xanthine oxidase 억제 활성의 결과보다는 높은 억제활성을 보였다. 특히, CH2Cl2 분획물과 EtOAc 분획물에서 비교적 높은 superoxide 소거 활성을 나타냈으며 IC50 값은 각각 98.84, 85.72 ㎍/㎖로 나타났다(Table 1).
세포 독성에 미치는 영향
LDH는 모든 세포의 세포질 안에 존재하는 효소로서 pyruvic acid와 lactic acid 간의 가역적 전환에 관여하여 촉매작용을 하며, LDH를 내포한 조직이 파괴될 때 혈액 중으로 흘러나와 혈중 LDH가 상승한다. RAW 264.7 세포 (1.5✕105 cells/㎖)에 시험 약물과 LPS (1 ㎍/㎖)를 동시 처리하여 24시간 배양한 후, LDH assay 방법을 이용하여 세포 독성을 확인한 결과, 좁은잎천선과나무의 조추출물 및 각각의 유기용매분획물에서 독성이 나타나지 않았음을 확인할 수 있었다(Fig. 1).
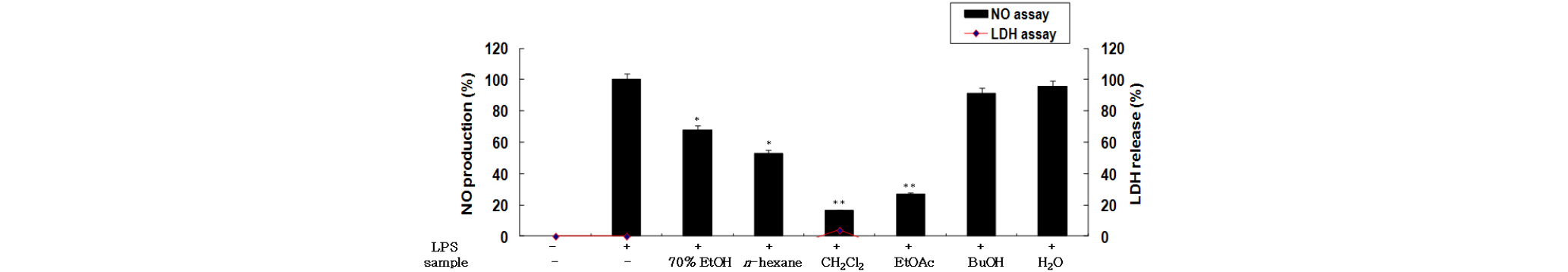
Fig. 1.
The effects of 70% EtOH and solvent fractions of FES on cell viability and nitric oxide production in RAW 264.7 cells. The production of nitric oxide was assayed in the culture medium of cells stimulated with LPS (1 ㎍/㎖) for 24 h in the presence of the 70% EtOH extract and the solvent fractions of FES (100 ㎍/㎖). Cytotoxicity was determined using the LDH method. Values are the mean ± SEM of triplicate experiments. *, P<0.05; **, P<0.01.
Nitric oxide 생성억제 효과
활성산소 중 하나이며, 최근 염증 유발에 중요한 역할을 하는 것으로 알려진 nitric oxide (NO) 생성에 대한 좁은잎천선과나무 잎 조추출물과 분획물의 효과를 알아보았다. 생성된 NO 양을 Griess 시약을 이용하여 세포배양액 중에 존재하는 NO2-의 형태로 측정하였다. 실험결과 n-BuOH 분획물과 H2O 분획물을 제외하고 좋은 NO 생성 억제효과를 보였으며, 그 중 CH2Cl2 분획물과 EtOAc 분획물에서 대조군인 LPS 단독처리군에 비해 강력한 NO 생성 억제 효과를 관찰할 수 있었으며, 항산화 활성이 높게 나타나는 EtOAc 분획물에서 농도 의존적으로 NO 생성이 억제하는 것을 확인할 수 있었다(Fig. 1, Fig. 2).
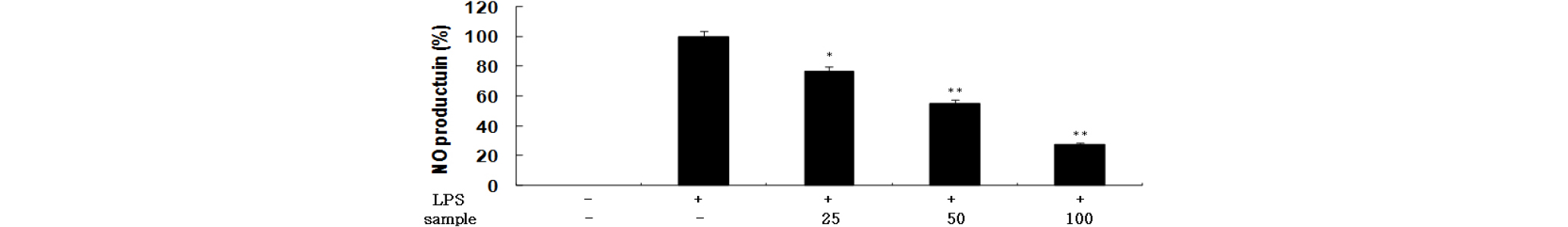
Fig. 2.
Inhibitory effect of EtOAc fraction of FES on nitric oxide production in RAW 264.7 cells. The production of nitric oxide was assayed in the culture medium of cells stimulated with LPS (1 ㎍/㎖) for 24 h in the presence of the EtOAc fraction of FES (25, 50 and 100 ㎍/㎖). Values are the mean ± SEM of triplicate experiments. *, P<0.05; **, P<0.01.
Pro-inflammatory cytokine 생성 억제 효과
Pro-inflammatory cytokine들은 정상조직에서 발현될 뿐만 아니라 병변 과정에서 그 발현 정도가 증가되며, 암촉진 과정에서 일어나는 피부염증에 중요한 역할을 한다. TNF-α, IL-1β, 그리고 IL-6 등과 같은 cytokine들은 인간의 염증성 피부질환과 관련이 있음은 이미 많이 보고되어 왔다. 또한 여러 염증질환과 알러지 현상에 cytokine들에 대한 항체를 처리하였을 때 증상이 완화되었다(Kim and Moudgil, 2008; Kim et al., 2009). 염증단계에 중추적 역할을 하고 있는 cytokine인 IL-1β와 IL-6의 발현을 저해시키거나 COX-2 활성저해에 기인하는 PGE2의 생성 억제를 통해 pro-inflammatory fator의 증가를 수반하는 병변 과정을 조절할 수 있을 가능성이 높다(Ren and Torres, 2009; Heo et al., 2010). 대식세포인 RAW 264.7 세포로부터 Pro-inflammatory cytokine의 생성 억제 정도를 확인한 결과, 좁은잎천선과나무 잎의 CH2Cl2 분획물과 EtOAc 분획물에서 TNF-α, IL-6와 IL-1β의 생성이 조추출물과 타 분획물 보다 상대적으로 높게 억제되었으며 항산화 활성이 높게 나타나는 EtOAc 분획물에서 농도 의존적으로 억제하는 것을 확인할 수 있었다(Fig. 3).
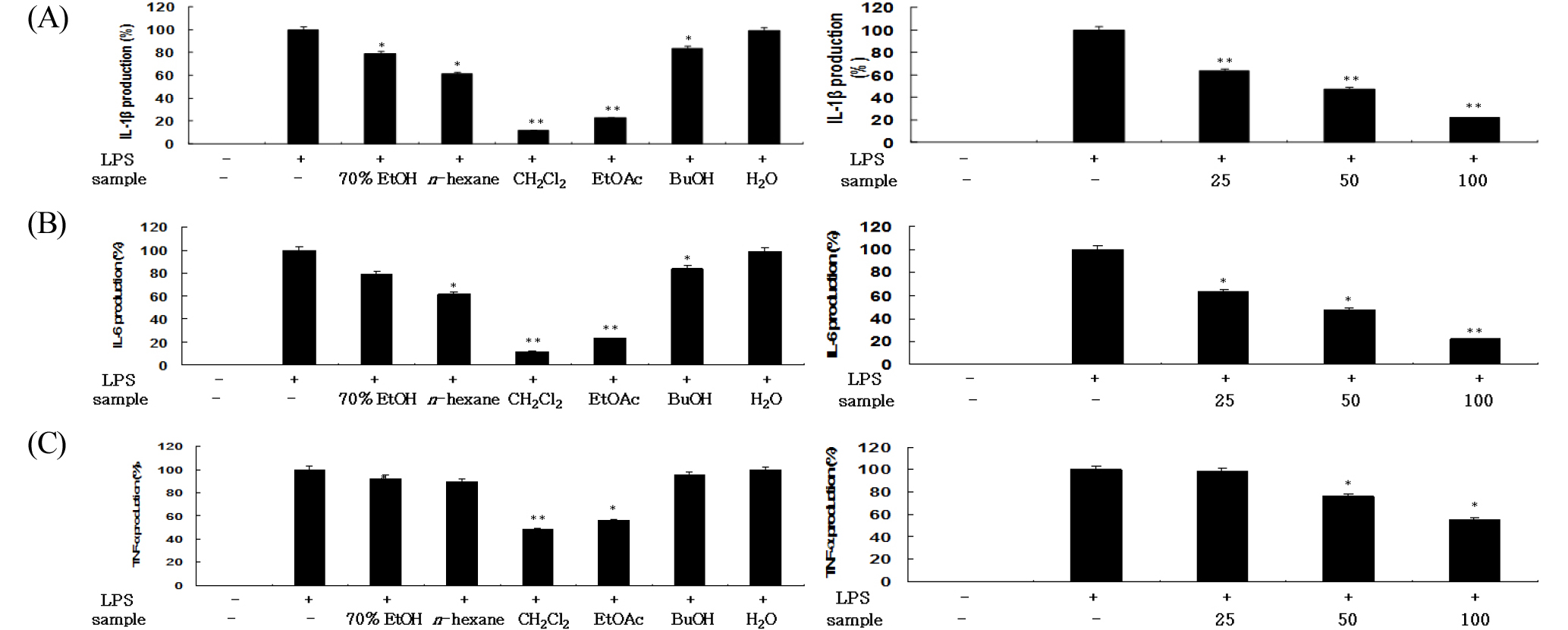
Fig. 3.
Inhibitory effect of 70% EtOH extract and solvent fractions (above) and EtOAc fraction (below) of FES on cytokines production in RAW 264.7 cells. Cells (1.5 × 105 cells/㎖) were stimulated by LPS (1 ㎍/㎖) for 24 h in the presence of 70% EtOH extract and solvent fractions from FES (100 ㎍/㎖). Supernatants were collected, and the cytokines concentration in the supernatants was determined by ELISA. Values are the mean ± SEM of triplicate experiments. *, P<0.05; **, P<0.01. Inhibitory effect of 70% EtOH extract and solvent fractions (above) and EtOAc fraction (below) of FES on IL-1β (A), IL-6 (B) and TNF-α (C) production in RAW 264.7 cells, respectively.
Prostagladin E2 (PGE2) 생성에 미치는 영향
Macrophage RAW 264.7 세포에서 염증성인자인 PGE2 억제효과를 ELISA kit를 이용하여 정량하였다. 그 결과 PGE2 생성억제는 n-hexane 분획물, n-BuOH 분획물과 H2O 분획물을 제외한 유기용매 분획물에서 높은 억제효과를 보여주고 있다. CH2Cl2 분획물은 92%, EtOAc 분획물은 84%의 억제효과를 보였으며(Fig. 4), 항산화 활성이 높게 나타나는 EtOAc 분획물에서 PGE2 생성이 농도 의존적으로 억제되고 있다(Fig. 5). 이러한 결과 LPS에 의해 발현되는 PGE2 억제에 영향을 준다는 것을 확인 할 수 있었다.
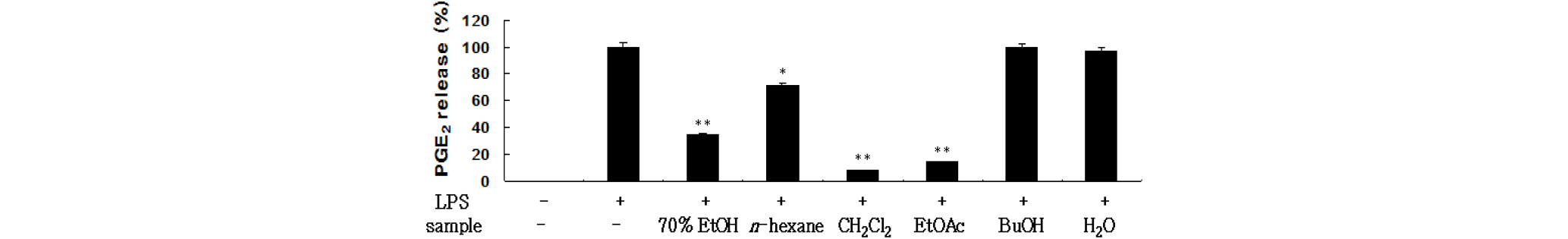
Fig. 4.
Inhibitory effects of the 70% EtOH extract and solvent fractions of FES on PGE2 production in RAW 264.7 cells. Cells (1.5 × 105 cells/㎖) were stimulated by LPS (1 ㎍/㎖) for 24 h in the presence of the 70% EtOH extract and the solvent fractions from FES (100 ㎍/㎖). Supernatants were collected, and the PGE2 concentration in the supernatants was determined by ELISA. Values are the mean ± SEM of triplicate experiments. *, P<0.05; **, P<0.01.
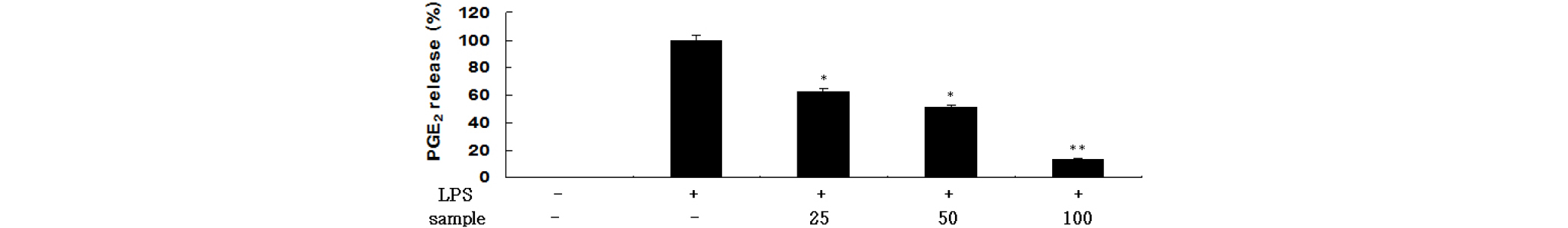
Fig. 5.
Inhibitory effects of EtOAc fraction of FES on PGE2 production in RAW 264.7 cells. Cells (1.5 × 105 cells/㎖) were stimulated by LPS (1 ㎍/㎖) for 24 h in the presence of EtOAc fraction of FES (25, 50 and 100 ㎍/㎖). Supernatants were collected, and the PGE2 concentration in the supernatants was determined by ELISA. Values are the mean ± SEM of triplicate experiments. *, P<0.05; **, P<0.01.
iNOS 생성에 미치는 영향
iNOS는 평소에는 세포 내에 존재하지 않으나 일단 유도되면 장시간 동안 다량의 NO를 생성하며, 생성된 NO는 병리적인 혈관확장, 세포독성, 조직손상 등과 같은 생체에 유해한 작용을 나타낸다. 그리고, 염증상태에서 iNOS에 의해 생성된 NO는 혈관 투과성, 부종 등의 염증반응을 촉진시킬 뿐만 아니라 염증매개체의 생합성을 촉진하여 염증을 심화시키는 것으로 알려져 있다(Tesuka et al., 2001; Santos-Gomes et al., 2003).
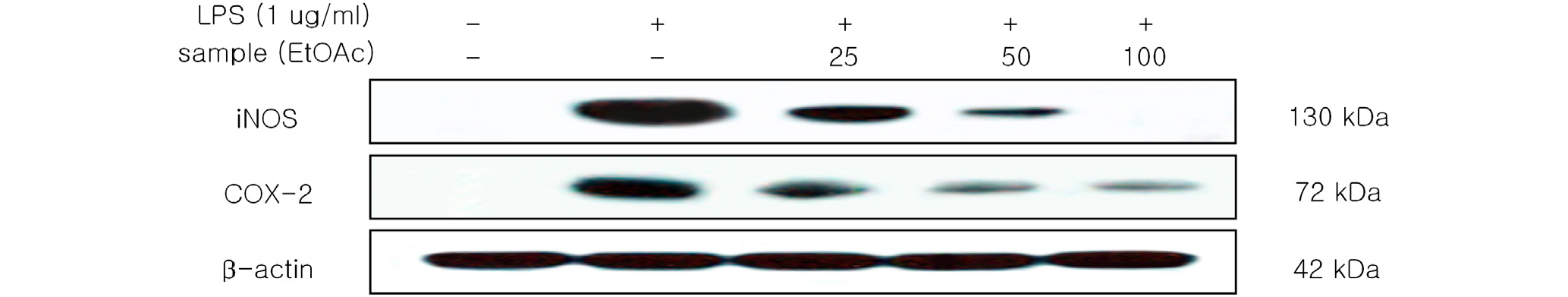
RAW 264.7 세포에 LPS (1 ㎍/㎖)를 사용하여 iNOS의 생성을 유도한 후 좁은잎천선과나무 잎 조추출물과 분획물을 처리하여 단백질 생성에 대한 억제 정도를 western blotting을 통해 알아보았다. 그 결과 단백질 수준에서도 n-BuOH 분획물과 H2O 분획물을 제외한 조추출물과 유기용매 분획물에서 좋은 억제효과를 보였으며, 그 중 CH2Cl2 분획물과 EtOAc 분획물에서 대조군인 LPS 단독처리군에 비해 강한 억제 효과를 나타내었고(Fig. 6) 항산화 활성이 높게 나타나는 EtOAc 분획물에서 PGE2 생성이 농도 의존적으로 억제되고 있음도 확인했다(Fig. 7). 이러한 결과 NO의 생성 억제가 iNOS 발현 억제를 통한 것으로 여겨진다.
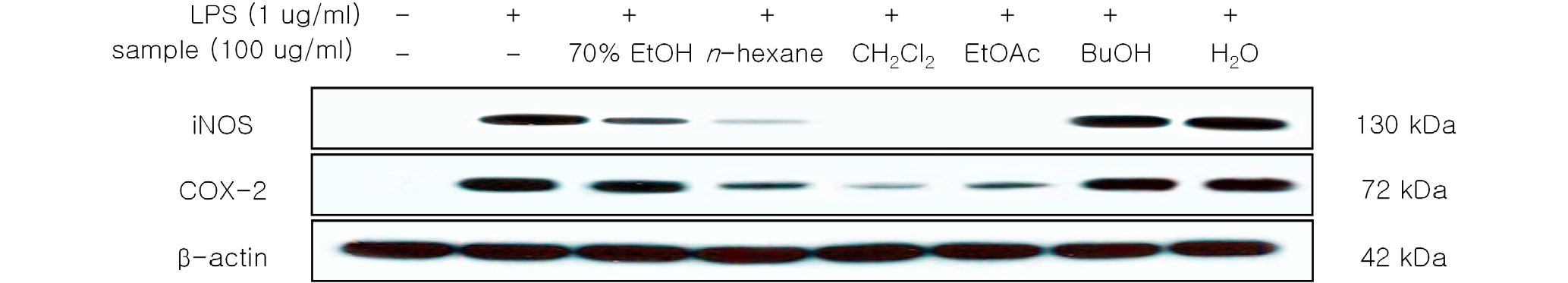
Fig. 6.
Inhibitory effect of 70% EtOH extract and solvent fractions of FES on the protein level of iNOS and COX-2 in RAW264.7 cells. RAW 264.7 cells (1.0 × 106 cells/㎖) were pre-incubated for 18 hr, and the cells were stimulated with LPS (1 ㎍/㎖) in the presence of 70% EtOH extract and solvent fractions of FES (100 ㎍/㎖) for 24 hr. iNOS and COX-2 protein levels were determined using immunoblotting method.
COX-2 발현에 미치는 영향
다수의 염증 억제 약물들의 작용기전은 prostagladin 합성 억제를 나타내며 이는 COX-2의 생성 및 활성저해에 의한 것이다. COX는 COX-1과 COX-2로 나뉘어 지는데 다양한 세포에서 각각 다른 발현 경향을 나타낸다. COX-1은 위 및 신장기능의 유지, 혈소판의 형성에 필요한 prostagladin의 합성에 작용하며, 상대적으로 COX-2는 동물이나 인간의 염증반응 부위에서 발현된다(Masferrer et al., 1994; Hyun et al., 2004). 따라서, COX-2에 의한 prostagladin의 합성은 염증반응을 매개하는 것으로 여겨진다. RAW 264.7 세포에 LPS (1 ㎍/㎖)로 자극을 주고 좁은잎천선과나무 잎 조추출물과 분획물을 처리하여 확인한 결과, 조추출물, n-BuOH 분획물과 H2O 분획물을 제외한 유기용매 분획물에서 억제효과를 나타났으며(Fig. 6) 항산화 활성이 높게 나타나는 EtOAc 분획물에서 COX-2 발현이 농도 의존적으로 억제됨을 확인하였다(Fig. 7). 따라서, 본 연구결과에서는 좁은잎천선과나무 잎의 알코올 추출물을 순차적으로 분획한 CH2Cl2 분획물과 EtOAc 분획물이 천연물 유래 항염증 소재로서 산업화 이용 가능성을 확인하였다. 특히, 항산화 활성과 항염증 활성을 보이고 있는 EtOAc 분획물을 활용한 추가연구를 통해 식의약품 소재 등 천연물 소재로서의 활용 가능성이 높을 것으로 사료된다.
적 요
본 연구는 좁은잎천선과나무 잎 추출물을 식의약품 소재 등 천연물 소재로 활용하기 위하여 항산화 및 항염증 활성에 대한 예비 평가를 기술하였다. 좁은잎천선과나무는 70% 에탄올을 사용하여 추출한 다음 헥산, 디클로로메탄, 에틸아세테이트 및 부탄올을 사용하여 순차적으로 분획하였다. 항산화 및 항염증제 효과를 효과적으로 스크리닝하기 위해 좁은잎천선과나무 잎 추출물이 산화 스트레스(DPPH, xanthine oxidase and superoxide) 생성에 미치는 억제 효과를 확인하였다. 또한, LPS로 활성화된 대식세포 RAW 264.7 세포에서 염증성 인자(NO, iNOS, COX-2, PGE2, IL-6 and IL-β)의 생성에 대한 좁은잎천선과나무 잎 추출물의 억제 효과를 확인하였다. 좁은잎천선과나무 잎 추출물의 용매분획물 중 디클로로메탄과 에틸아세테이트 분획물은 산화 스트레스(DPPH, xanthine oxidase and superoxide)의 생성 감소가 있었고, 좁은잎천선과나무 잎 추출물의 헥산과 디클로로메탄 분획물은 염증 유발인자(NO, iNOS, COX-2, PGE2, IL-6, and IL-β)의 생성을 억제하였다. 또한, 디클로로메탄 분획물은 염증성 사이토카인(TNF-α, IL-6, and IL-1β)의 생성을 억제하였다. 이러한 결과는 좁은잎천선과나무 잎 추출물이 산화 스트레스 및 염증 유발 인자에 유의한 영향을 미치고 있어 산화방지제 및 항염증제와 같은 천연물 소재로 활용될 수 있을 것으로 사료된다.