서언
재료 및 방법
실험 재료
세포배양
세포생존율 분석
단백질 분석
Tunel 분석
Caspase-3 활성도 측정
FACS 분석
통계처리
결과 및 고찰
Iridin의 신장세포 보호 효과
Iridin의 caspase-3 신호전달 억제효과
Iridin의 HK-2 세포 괴사, 미토콘드리아 과활성 억제효과
암세포에서 doxorubicin에 대한 iridin의 역할
적요
서언
Doxorubicin은 adriamycin으로도 잘 알려져 있으며, 암세포를 억제하는 항암제로 사용되고 있다. 이는 암세포에서 DNA 사이에 삽입(intercalation)되어 DNA합성을 방해할 뿐만 아니라 DNA 수리를 담당하는 topoisomerase-2를 억제하며, 산화스트레스를 유도함에 따라 암세포의 사멸을 유도 한다(Thorn et al., 2011). Doxorubicin은 이러한 효과 외에도 암환자에게 투여했을 때 심근독성과 신장독성을 일으킨다고 알려져 있다(Yoon et al., 2011; Kim and Cho, 2016). 국내 암환자 수는 매년 증가되는 추세이고, 항암 치료에 사용되는 항암제들은 doxorubicin과 마찬가지로 대부분 장기에 독성을 일으키는 부작용이 함께 나타난다(Tacar et al., 2013). 이러한 부작용 때문에 현재 항암제의 부작용을 줄이면서 항암효능을 증진시킬 수 있는 천연물 또는 천연분리물질의 탐색과 연구가 필요하다.
Caspase-3 단백질은 caspase family에 속하는 단백질로 평소 세포내부에서 불활성화 상태로 존재하다가 자극을 받게 되면 활성화 상태로 바뀌게 된다(Yuan et al., 2016). 뿐만 아니라 caspase-3 단백질은 세포내부에서 apoptosis 또는 necrosis가 일어나는 동안에 DNA 수리에 관여하는 PARP1 단백질을 절단해 DNA 수리를 억제함에 따라 세포 수복을 억제하며 다양한 세포에서 세포죽음에 관련된 중요한 인자로 이용되고 있다(Yoon et al., 2015).
진핵세포의 세포주기는 크게 G1, S, G2, M기로 나누어져있으며, 각각 단계마다 다음 단계로 진행에 관여하는 체크포인트가 존재한다. 이에 관여하는 여러 단백질들의 상호작용을 통해 세포주기가 촉진되거나 억제되며(Park et al., 2013), CDK4와 CDK6 단백질은 G1-S 진행에 관여하는 단백질이다(Marcos, 2014). Doxorubicin은 암세포에서 CDK4와 CDK6의 발현을 억제하는 것을 통해 암세포의 세포 주기를 억제한다고 알려져 있다(Tarasewicz et al., 2014; Tadesse et al., 2015).
최근 천연 소재 개발 연구가 여러 방면에서 이루어지고 있고, 예로부터 사용된 자원식물의 항염증, 항산화 등 여러 이로운 효능이 알려지면서 자원식물에 대한 중요성이 대두되고 있다(Park et al., 2017; Guo and Wang, 2017; Choi et al., 2017). 노랑붓꽃(Iris koreana Nakai)은 우리나라 중부 이남에 주로 분포하는 식물로 변산반도와 내장산 인근에 많이 분포하고 있는 것으로 알려져 있으며(Pi et al., 2016A), 자생지의 식생현황과 식생구조를 분석을 통해 생태학적인 기초자료를 구축하는 연구가 활발히 진행되고 있지만(Pi et al., 2016B) 노랑붓꽃에 대한 계통분류학적 또는 생장 및 개화에 관한 연구를 제외하고 본초학적 효능 및 기전 연구가 전무한 실정이다(Lee et al., 2007; Lee and Park, 2013; Eom et al., 2013). 따라서 본 연구는 doxorubicin에 의해 유발된 신장독성 세포 모델에 노랑붓꽃 전초에서 분리한 iridin을 처리하여 신장독성 억제 효과 또는 신장 세포에 대한 iridin의 독성이 나타나는지 조사해보고자 하였다.
재료 및 방법
실험 재료
실험에 사용한 iridin은 노랑붓꽃 전초에서 분리된 천연물질로, 천연물 물질은행(NPBANK, Gungsan, Korea)에서 파우더 형태로 분양받아 사용하였다. Iridin은 0.9% NaCl에 녹여 사용하였으며, doxorubicin (Sigma, St. Louis, Missouri, USA)은 1% DMSO (dimethyl sulfoxide)에 완전히 녹인 후 차광상태로 냉동보관 하고 실험에 사용하였다.
세포배양
HK-2 세포(Human kidney proximal tubule cell), NCI-H1229 (Human non-small cell lung cancer cell)과 HCT-116 (Human colorectal cancer cell)은 한국세포주은행(KCLB, Seoul, Korea)으로부터 분양받아 사용하였다. HK-2 세포와 NCI-H1229 세포는 PRMI 1640 배지(Thermo, Waltham, Massachusetts, USA)를, HCT-116 세포는 DMEM (Thermo, Waltham, Massachusetts, USA)을 사용하였고, 사용된 배지에 10% FBS (fetal bovine serum), 1% penicilin/streptomycin을 첨가하여 사용하였으며, 37℃, 5% CO2 조건에서 배양하고 유지하였다.
세포생존율 분석
세포생존율은 CellTiter 96® AQueous One Solution Cell proliferation assay kit (Promega, Fitchburg, Wisconsin, USA)를 사용하였으며, 제조사의 프로토콜에 따라서 측정하였다. HK-2 세포를 96 well plate에 1×105 cells/㎖ 농도가 되도록 분주한 뒤 37℃, 5% 배양기에서 24시간 배양한 후 iridin을 각각 10, 20, 40 그리고 80 μM 농도로 24시간 동안 처리하여 천연분리물질에 대한 독성을 조사하였고, 이와 같은 농도로 1시간 동안 전 처리한 뒤 10 μM doxorubicin을 처리하고 24시간동안 배양하였다. 24시간 뒤 MTS 시약 20 ㎕를 넣고 2시간 동안 배양한 후 microplate reader Infinite® 200 PRO (TECAN, Mannedorf, Switzerland)를 이용하여 490 ㎚에서 흡광도를 측정하였다. 세포생존율은 정상대조군에 대한 생존율로 표시하였고, 이에 따라 보호효과가 있는 농도를 확인하였다.
단백질 분석
Doxorubicin과 iridin 처리 후 배양이 끝난 HK-2 세포는 PBS로 세척한 뒤 Pierce™ Protease and Phosphatase Inhibitor Mini Tablets (Thermo, Waltham, Massachusetts, USA)가 함유된 RIPA cell lysis buffer 2 (Enzo, Farmingdale, USA)로 1시간 동안 용해했다. 세포용해액은 원심분리기로 4℃, 13,000×g 조건에서 10분 동안 원심분리 하였으며, Bradford 단백질 정량법을 이용해 각각 샘플에 대한 단백질의 농도를 측정했다. 20 ㎍의 단백질 샘플을 SDS-PAGE로 분리하였고, 분리된 SDS-PAGE 겔은 Thermo Scientific Pierce G2 Fast Blotter (Thermo, Massachusetts, USA)를 사용하여 PVDF membrane (GE healthcare life sciences, Little chalfont, Germany)으로 이동시켰다. Membrane은 5% skim milk가 포함된 Tris buffered saline + 0.05% Tween-20으로 blocking 한 뒤 1차 항체를 반응시키고, anti-rabbit과 anti-mouse 2차 항체를 이용하여 D-Plus™ ECL Femto System (Donginbio, Souel, Korea)를 이용해 단백질을 확인하였다.
Tunel 분석
Tunel 분석은 DeadEnd™ Fluorometric TUNEL System (Promega, Fitchburg, Wisconsin, USA)을 사용하였으며, 제조사의 프로토콜에 따라서 수행하였다. HK-2 세포를 12 well plate에서 cover slip 위에 2×105 cells/㎖ 농도가 되도록 분주한 뒤, 37℃, 5% 배양기에서 24시간 배양했다. 배양된 세포는 80 ㎕ iridin을 1시간 동안 전 처리 한 뒤 10 μM doxorubicin을 처리하고 24시간동안 배양하였다. 그 후 10% neutralized buffered formalin (NBF)로 4℃에서 20분 동안 고정하였고, phosphate buffered saline (PBS)로 2번 씻어주었다. 다음 0.2% Triton X-100 in PBS 용액으로 5분간 투과화한 뒤 PBS로 2번 씻어주었다. 남은 액체가 없도록 모두 제거하고 Equilibration buffer를 5분간 처리하였으며, 100 ㎕ rTdT incubation buffer를 처리하고 37℃에서 1시간 동안 배양하였다. 그 후 2×SSC buffer를 처리하고, PBS로 2번 씻은 뒤 Prolong™ Gold Antifade Mountant with DAPI (Thermo, Waltham, Massachusetts, USA)로 봉입하여 Epi-fluorescence microscope (Carl Zeiss, Oberkochen, Germany)를 이용해 형광 정도를 관찰하였다.
Caspase-3 활성도 측정
Caspase-3 의 활성도는 Caspase-3 colorimetric detection kit (Enzo, Farmingdale, USA)를 이용해 실험을 진행했다. 단백질 분석 방법에서 이용한 방법으로 세포를 용해하였고, 20 ㎍의 단백질을 사용해 제조사가 제공한 프로토콜에 따라 실험을 진행했다.
FACS 분석
Annxon V-FITC apoptosis detection kit (Enzo, Farmingdale, USA)를 사용하였다. HK-2 세포에 약물 처리 후 유도되는 apoptosis의 비율을 구분하기 위해 제조사의 프로토콜에 따라 annexin V-FITC와 propidium iodide (PI) 형광염료로 염색시켰으며, mitochondrial membrane potential (MMP)의 비율을 측정하기 위해 JC-1 Dye (Thermo, Waltham, Massachusetts, USA)를 사용하여 실험을 진행하였다. 각각 형광염료로 염색된 세포는 유세포분석기(FACS)를 이용하여 분석하였다.
통계처리
통계처리는 평균 ± 표준편차(mean ± SD)로 나타냈다. 유의성을 검정하기 위해 SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA) 통계 프로그램을 사용하였다. 일원변량분석(one way ANOVA)을 실시하였으며, 유의성이 있는 경우 p< 0.05 수준에서, Duncan's Multiple Range Test (DMRT)와 Tukey post-hoc test를 실시하였다.
결과 및 고찰
Iridin의 신장세포 보호 효과
HK-2 세포에 대한 iridin의 세포독성과 doxorubicin에 대한 세포보호효과를 확인하기 위해 MTS 분석을 진행하였다. Iridin을 여러 농도로 24시간 동안 처리하였을 때, HK-2 세포에 대한 자체독성은 나타나지 않았다(Fig. 1A). 다음으로 iridin을 여러 농도로 전 처리하고 10 μM doxorubicin을 함께 처리하였을 때, doxorubicin 단독처리군은 정상대조군에 비해 세포생존율이 76.9 ± 3.0%로 감소하였다. 하지만 80 μM iridin을 전 처리 했을 경우 세포생존율이 94.6 ± 2.6%까지 회복되는 결과를 확인하였다(Fig. 1B). 실험결과를 종합해봤을 때 iridin은 HK-2 세포에 대해 독성을 나타내지 않았으며, 10 μM doxorubicin 처리에 의한 세포독성도 80 μM iridin을 전 처리했을 때 세포생존율이 회복되었다. Iridin이 doxorubicin으로 유도한 HK-2 세포 독성에 대한 보호효과가 있음을 확인하였다. 그러나 MTS assay는 apopotosis와 necrosis 등 다양한 세포 사멸경로를 특이적으로 분석할 수 없는 단점이 있기 때문에 doxorubicin에 의한 세포사멸 경로와 이에 대한 iridin의 억제효과가 어떤 단백질 신호전달경로를 통해 일어나는지 알아보기 위해 다음 실험을 진행하였다.
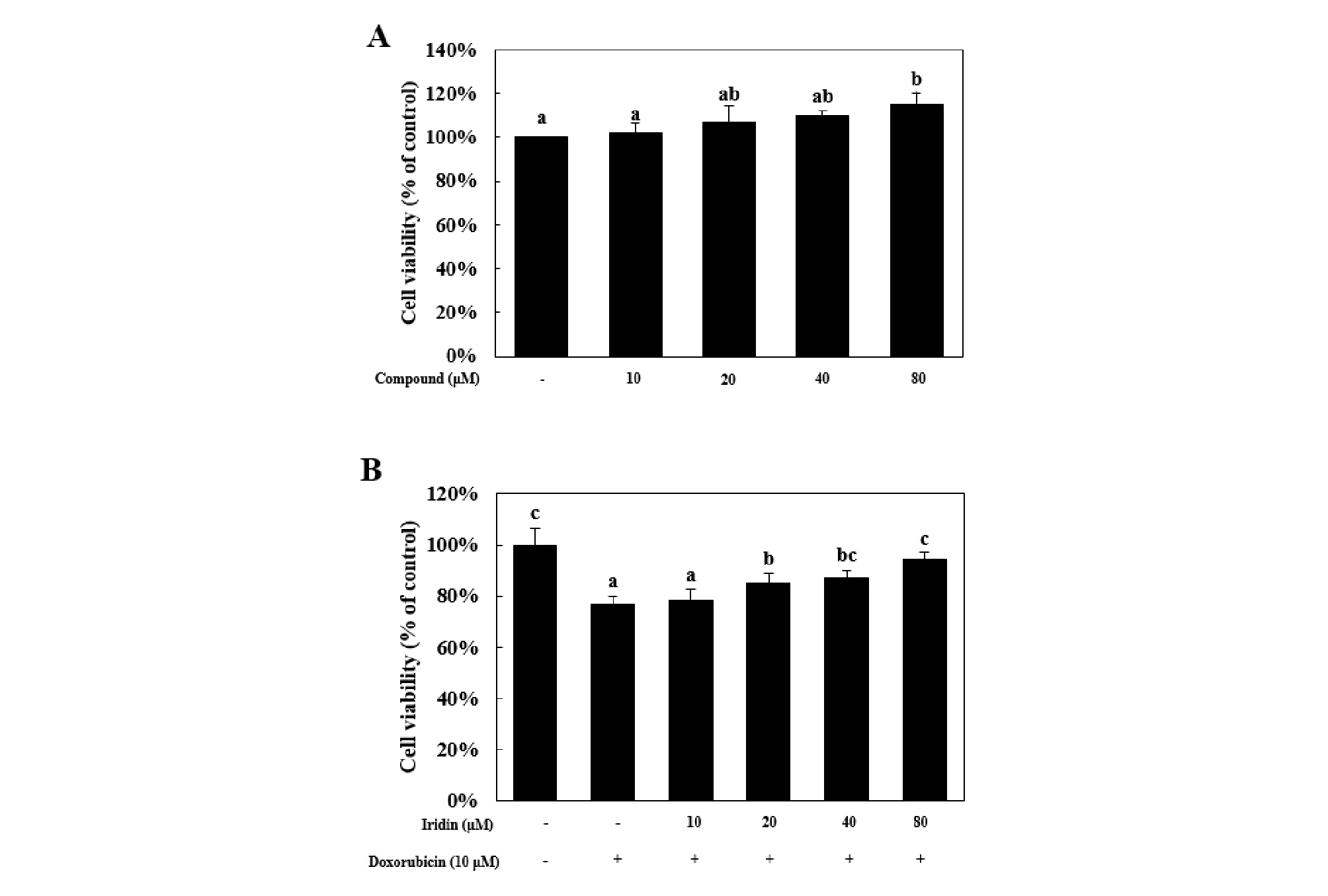
Fig. 1.
Iridin reduces doxorubicin-induced cell death in HK-2 cells. (A) HK-2 cells were treated with iridin for various concentration. (B) After pretreatment with iridin for various concentration, HK-2 cells were treated with 10 μM doxorubicin for 24 h. Cell viability was measured by MTS assay. Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p< 0.05 by Duncan's Multiple Range Test.
Iridin의 caspase-3 신호전달 억제효과
세포사멸에 관여하는 단백질인 poly (ADP-ribose] polymerase 1 (PARP1)과 caspase-3의 단백질 발현정도를 확인하기 위해 western blot을 이용한 단백질 분석을 진행하였다. 10 μM doxorubicin을 24시간 동안 처리하였을 때 caspase-3와 PARP1의 cleaved 형태가 증가하였고 80 μM iridin을 전 처리했을 때 억제되는 결과를 확인했다. Doxorubicin은 세포 내부에서 세포주기에 관여하는 cyclin-dependent kinase 4 (CDK4)와 cyclin- dependent kinase 6 (CDK6)를 억제한다고 알려져 있어(Tarasewicz et al., 2014; Tadesse et al., 2015), 단백질 발현량을 확인해본 결과 10 μM doxorubicin 처리했을 때 CDK4와 CDK6의 단백질 발현량이 조금 감소되는 경향이 나타나고, 80 μM iridin을 전 처리했을 때 약간 회복되는 것을 확인 할 수 있었지만 이는 유의적인 차이가 없었다(Fig. 2A). 추가적으로 caspase-3 활성도를 확인해본 결과 앞선 결과와 마찬가지로 10 μM doxorubicin을 처리했을 때 정상대조군에 비해 caspase-3 활성도가 143 ± 8.6%까지 증가되었으며, 이는 80 μM iridin 처리에 의해 110 ± 4.4%까지 감소됨을 확인하였다(Fig. 2B). 결과를 종합하자면 HK-2 세포에서 10 μM doxorubicin 처리는 caspase-3 단백질을 활성과 발현량을 증가시켰지만 이는 80 μM iridin을 전 처리 했을 때 모두 차단되었다. 하지만 CDK4와 CDK6의 단백질 발현량 뿐만 아니라 세포주기를 확인하는 추가적인 실험이 필요할 것으로 생각되며, 다음으로 iridin이 어떤 apoptosis 또는 necrosis와 같은 특정 세포사멸기전에 영향을 미치는지 알아보기 위해 다음 실험을 진행하였다.
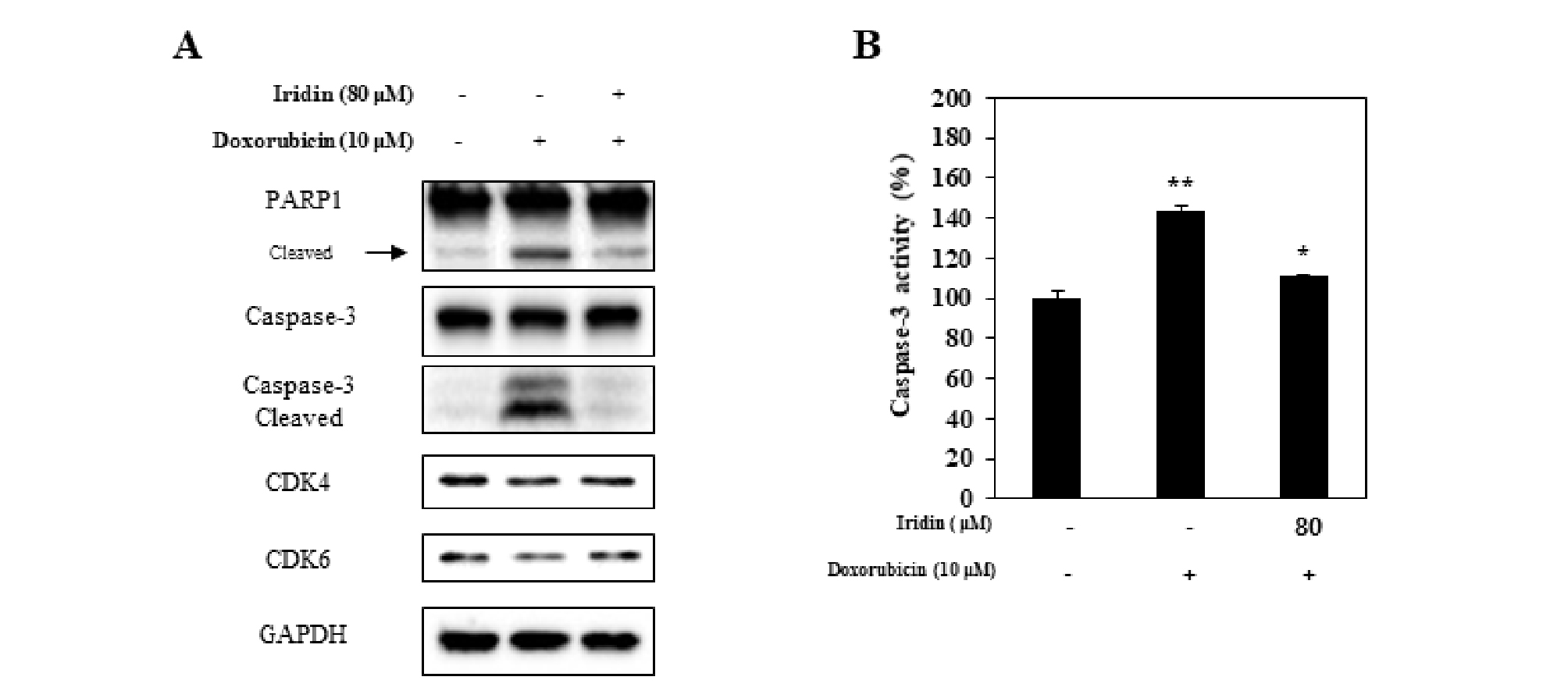
Fig. 2.
Iridin reduces doxorubicin-induced caspase-3/MST-1 signaling pathway in HK-2 cells. After pretreatment with 80 μM iridin for 1 h, HK-2 cells were treated with 10 μM doxorubicin for 24 h. Cell extracts were subjected to protein analysis using western blot and caspase-3 activity assay. (A-B) Data represent the mean± SEM of three independent experiments. **p< 0.05 vs. control, *p< 0.05 vs. 20 μM cisplatin.
Iridin의 HK-2 세포 괴사, 미토콘드리아 과활성 억제효과
Tunel 분석은 세포 내부에서 apoptosis 또는 necrosis에 의해 일어난 DNA 단편화(DNA fragmentation)를 시각화하는 방법으로, 10 μM doxorubicin 처리에 의해 증가된 tunel signal이 80 μM iridin을 전 처리했을 때 감소되는 결과를 확인하였다(Fig. 3A). 다음으로 iridin의 세포 보호효과가 세포 내부의 apoptosis 또는 necrosis를 억제하는지와 그 비율을 알아보기 위해 annexin-V/PI 염색을 이용해 실험을 진행하였다. 그 결과 10 μM doxorubicin처리는 세포 내부의 necrosis 비율을 68.5%까지 증가시켰으나 이는 80 μM iridin 처리에 의해 34.5%까지 감소되는 결과를 나타냈다(Fig. 3B). 미토콘드리아의 활성은 necrosis로 진행될 때 과활성화 된다고 알려져 있으며(Shin et al., 2015), 이에 따라 JC-1 염색을 통해 미토콘드리아의 활성을 확인한 결과 앞선 결과와 마찬가지로, 10 μM doxorubicin을 HK-2 세포에 처리했을 때 증가된 미토콘드리아 활성이 80 μM iridin을 처리했을 때 정상에 가깝게 억제되는 것을 확인하였다(Fig. 3C). 결과를 종합하자면 10 μM doxorubicin 처리에 의해 증가된 HK-2 세포의 미토콘드리아의 과활성과 necrosis, DNA 단편화는 80 μM iridin 전 처리에 의해 감소되었다. 이는 iridin이 doxorubicin에 의한 HK-2 세포의 necrosis를 억제하는 것으로 보이며, doxorubicin에 의해 유도되는 산화스트레스나 necrosis 초기에 관여하는 신호전달경로 그리고 세포주기의 비율을 추가적으로 확인해야할 뿐만 아니라 doxorubicin으로 유도된 신장독성 동물모델에서도 iridin이 보호효과를 나타낼 수 있는지 추가적인 연구가 필요하다고 생각된다.
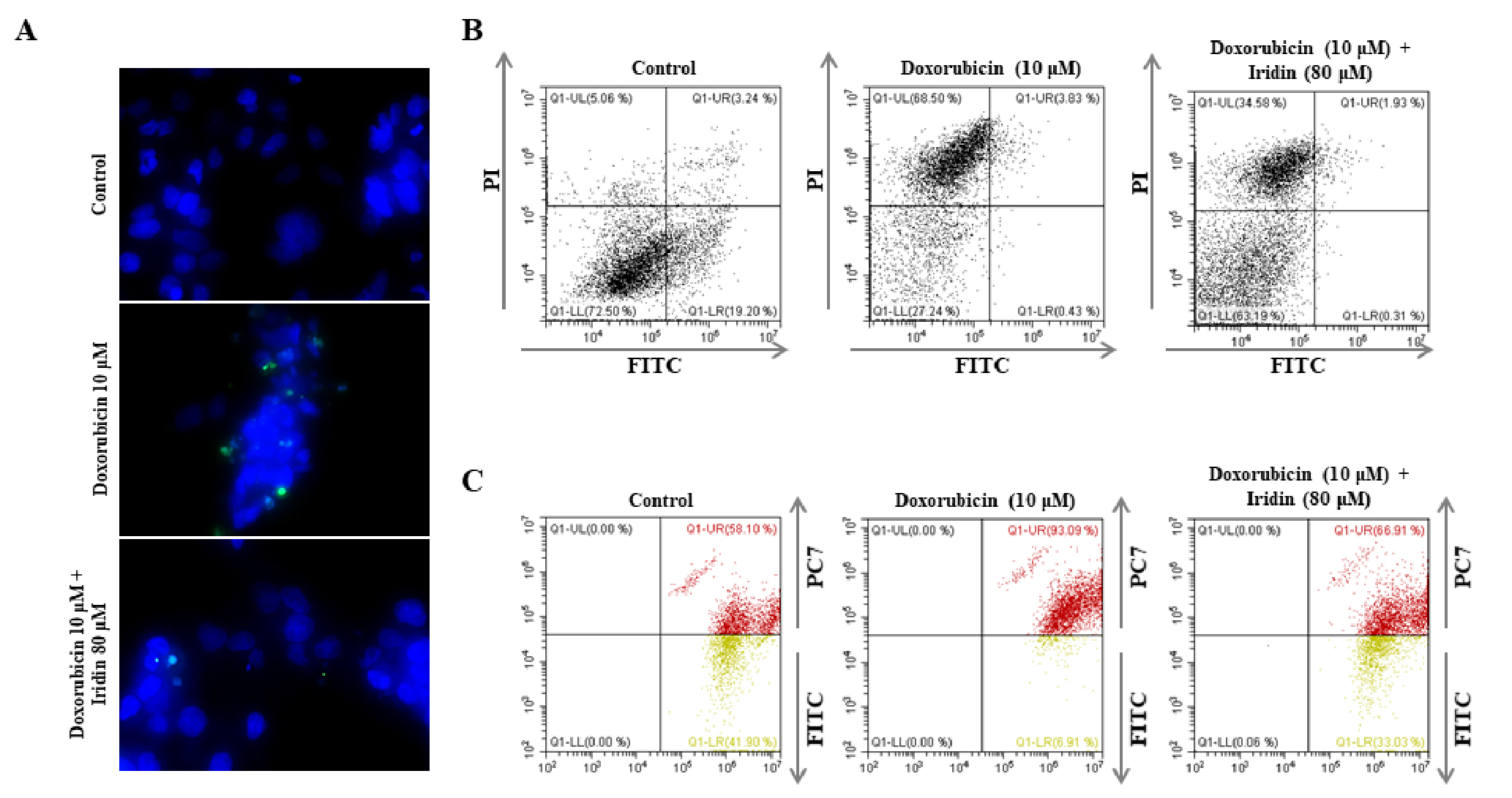
Fig. 3.
Iridin ameliorates doxorubicin-induced necrosis and the mitochondrial over activation in HK-2 cells. After pretreatment with 80 μM iridin for 1 h, HK-2 cells were treated with 10 μM doxorubicin for 24 h. (A) HK-2 cell visualized by tunel assay. (B) Annexin V and propidium iodide staining and (C) JC-1 staining were analyzed by flow cytometry. Representative images were taken from at least three independent experiments.
암세포에서 doxorubicin에 대한 iridin의 역할
이상의 결과를 종합하면 iridin은 doxorubicin에 의해 유도된 신장세포의 괴사를 억제하는 것으로 사료된다. 이어 같은 조건하에도 iridin이 doxorubicin으로 유도되는 암세포의 사멸에 어떻게 관여할 것인지 알아보기 위해 실험을 진행하였다. 실험에 사용된 세포주는 휴먼 유래 폐암세포주인 NCI-H1229와 대장암세포주인 HCT-116을 이용하였다. HK-2 세포에서 확인한 단백질 인자를 추가로 확인하였을 때 NCI-H1229 세포에서 10 μM doxorubicin에 의해 PARP1과 caspase-3의 cleaved 형태가 증가하였을 뿐만 아니라 CDK4와 CDK6의 발현량이 감소되었다. 하지만 예상했던 결과와 다르게 80 μM iridin 처리에 의하여 정상대조군과 가깝게 회복되는 결과를 나타냈다(Fig. 4A and 4C). 흥미롭게도 HCT-116 세포는 10 μM doxorubicin처리에 의해 감소된 CDK4와 CDK6 단백질이 NCI-H1229 세포와는 다르게 80 μM iridin 처리에 의해 회복되지 않았지만, caspase-3의 cleaved 형태를 조금 회복시키는 것으로 나타났다(Fig. 4B and 4C). 이는 iridin 처리가 폐암세포에 대해 doxorubicin의 효과를 억제하는 것으로 나타났을 뿐만 아니라 대장암세포에서 doxorubicin처리에 의한 세포주기억제를 제외한 세포사멸효과에 관여 한다고 생각된다. 이에 따라 폐암세포에서 doxorubicin과 iridin의 병용처리는 어렵다고 생각된다. 그러나 대장암세포에서 caspase-3의 cleaved 형태 조금 감소시키지만 CDK4와 CDK6를 통한 doxorubicin의 세포 성장억제를 iridin이 방해하지 않는 것으로 생각되지 때문에, 신장독성 동물모델과 대장암 관련 동물실험을 통해 iridin의 역할을 추가적으로 확인해야 된다고 생각된다.
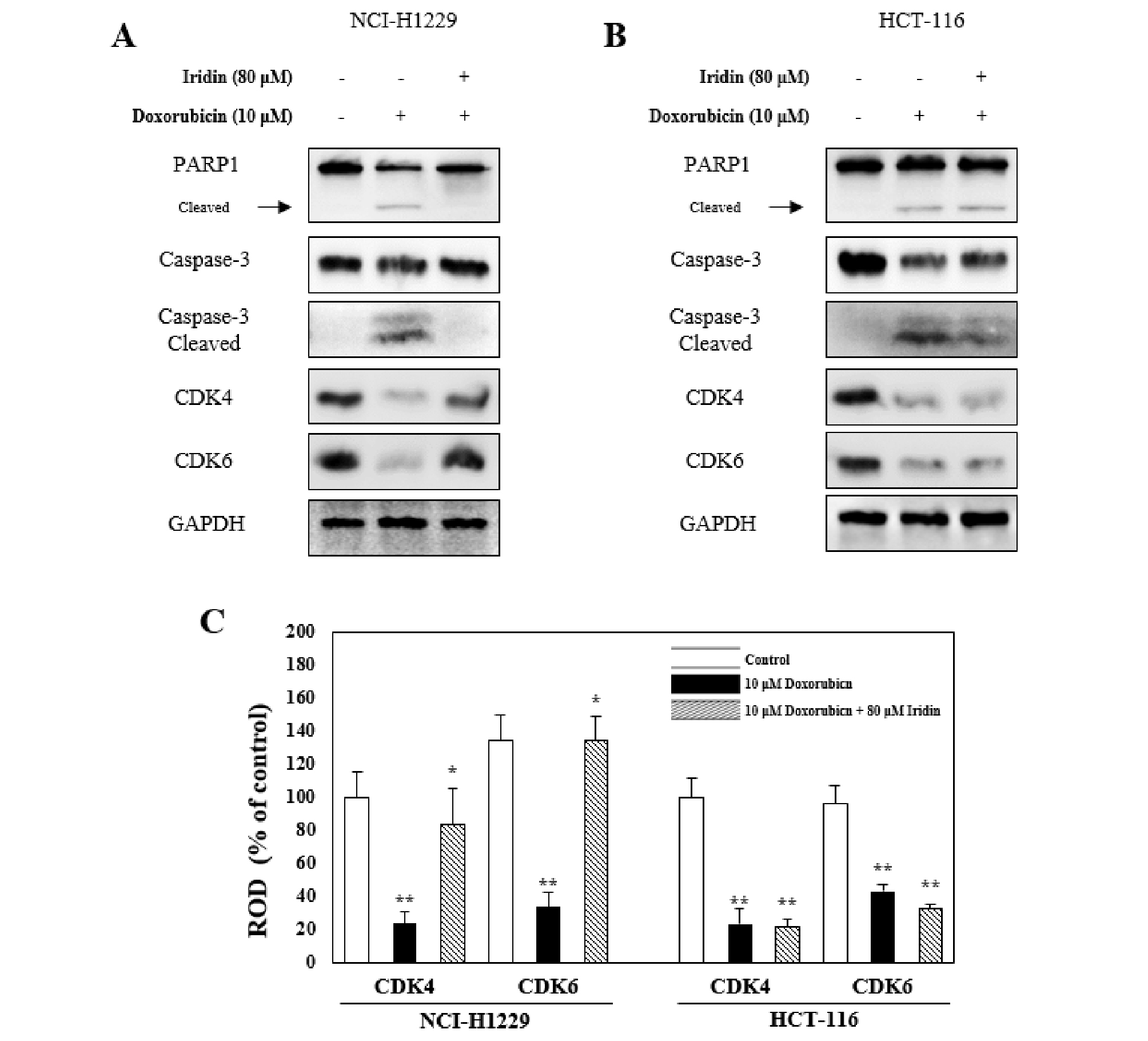
Fig. 4.
Role of iridin on doxorubicin treatment in NCI-H1229 and HCT-116 cells. After pretreatment with 80 μM iridin for 1 h, HK-2 cells were treated with 10 μM doxorubicin for 24 h. (A) NCI-H1229 cells. (B) HCT-116 cells. (C) Relative optical density. Data represent the mean± SEM of three independent experiments. **p< 0.05 vs. control, *p< 0.05 vs. 10 μM doxorubicin.
적요
노랑붓꽃에서 분리된 iridin의 doxorubicin으로 유도된 신장세포괴사 모델에 대한 보호 효과 및 암세포에 대한 작용을 알아보기위해 연구를 수행하였다. Iridin 단일 처리로는 신장근위세뇨관 세포주에 대해 독성을 나타내지 않았으며, 80 μM의 농도에서 10 μM doxorubicin 처리에 의한 세포사멸을 94.6 ± 2.6%까지 회복시켰다. 또한 80 μM iridin 처리는 10 μM doxorubicin 처리에 의해 증가된 cleaved PARP1과 cleaved caspase-3를 포함하는 세포사멸 신호전달을 차단하였을 뿐만 아니라 DNA fragmentation, necrotic cell death 및 mitochondrial dysfunction을 개선시켰다. 마지막으로 암세포에서 iridin의 효과를 확인해본 결과, 폐암세포주인 NCI-H1229 세포에서 doxorubicin의 항암효과를 억제하는 경향이 나타났지만 대장암 세포주인 HCT-116 세포주에서는 암세포에 대한 성장억제를 방해하지 않는 것으로 확인되었다. 따라서 폐암세포에서 doxorubicin과 iridin의 병용처리는 힘들다고 판단되고, In vivo 수준에서 신장독성 및 대장암 관련 실험을 통해 iridin의 역할을 추가적으로 확인해야한다고 생각된다.




