서언
진퍼리고사리[Leptogramma pozoi (Lag.) Ching subsp. mollissima (Fisch. ex Kunze) Nakaike](KPNI, 2019)는 울릉도와 제주도에서 자생하며 대만, 스리랑카, 인도, 일본, 중국 등지에 분포한다. 처녀고사리과(Thelypteridaceae) 진퍼리고사리는 남방계 식물이며, 잎의 엽병은 연한 녹색 또는 갈색으로 길이 10~30 ㎝이다. 갈색의 털이 있으며, 기부의 인편은 진한 갈색이고 길이 3~9 ㎜이며, 엽병의 상부 인편의 길이는 2~5 ㎜이다. 엽신은 길이 20~40 ㎝, 너비 8~20 ㎝이며, 2회 우상복엽 된다. 우편은 피침형으로 예두 또는 꼬리모양으로 길어지며 자루가 없는 형태를 띈다(KPNI, 2019). 양치식물은 잎이 녹색으로 풍성하고 신선한 느낌을 주며, 내음성이 강하고 장식성이 뛰어나 공원이나 정원 등 실내·외 장식용 소재로 많이 이용되는 원예식물이다(Jeong and Lee, 2006). 그러나 진퍼리고사리는 개체수가 적어 다방면으로 이용하기에 어려움을 겪고 있어, 개체수 확보를 위한 대량번식방법의 확립이 요구된다. 일반적인 양치식물은 무성세대와 유성세대가 서로 교차되는 생식습성을 가지고 있다. 유성세대에서 포자엽이 성숙하면 포자낭에서 포자가 방출되고 적합한 환경에서 발아되어 전엽체로 발달하게 된다. 전엽체가 성숙하여 장란기와 장정기가 형성되고 정자와 난자가 수정하면서 포자체가 형성된다. 그리고 성숙한 포자체는 다시 포자를 형성하여 방출하는 생활환이 반복된다(Jang et al., 2019; Lee, 2000). 양치식물은 포자를 발아시켜 포자체를 형성하기까지 오랜기간이 소요되고, 개체형성에 외부의 환경조건이 영향을 미쳐 균일한 식물체를 얻기 어렵다(Cho et al., 2017). 실제 농가에서는 근경, 포복지와 같은 영양기관을 주로 번식에 이용하고 있으나, 적지 않은 노동력이 소요된다. 고사리의 근경을 이용한 재배 시 증식은 1년간 약 5~10배로 증가량이 적으며, 성체를 이식할 경우 뿌리 발달이 약세하여 활착이 안정적이지 않다(Shin et al., 2009).
조직배양 기술은 기내에서 동일한 식물체를 대량생산 할 수 있는 방법으로 포자나 영양기관번식의 문제점을 해결할 수 있다(Shin and Lee, 2011). 최근 여러 종에서 조직배양을 통한 증식법이 연구되고 있으며, Dryopteris varia, Osmunda japonica와 같은 식물에서 전엽체 증식과 포자체 생산을 위한 대량번식방법이 개발되고 있다(Fernández et al., 1997; Jeong and Lee, 2006). 포자체 생산 시 기외이식을 통해 전엽체에서 포자체로 전환을 촉진시키고, 식물종에 따른 포자체 형성 및 생육에 효과적인 토양 조성을 구명하는 것이 중요하다. 따라서 본 연구는 원예작물로서 조경 및 분화용으로 이용가치가 높아 수요가 증가할 것으로 예상되는 진퍼리고사리의 효과적인 번식법을 확립하기 위하여 조직배양을 이용한 효과적인 대량 증식법을 개발하고자 하였다. 이를 위하여 개체 증식에 적합한 배지 종류와 배지 내 무기물 구성 및 포자체 형성을 위한 배양토 조성비 조건을 검토하였다.
재료 및 방법
실험재료
2015년 제주도 서귀포시 상효동 일대에서 식물체를 채집하여 충북대학교 부속농장의 비닐하우스에서 재배하였다. 포자엽이 성숙하는 6월에 포자엽을 채취한 다음 정선하였다. 정선한 포자는 Knop (1865) 배지에 파종하였으며, 배양환경은 온도 25±1℃, 광주기 16/8 시간으로 조정하였고, 광량은 30±1.0 μmol·m-2·s-1로 설정하였다. 예비실험에서 8주 이상 계대배양시 노화되는 경향이 나타나 포자발아로부터 획득한 전엽체를 8주 간격으로 계대배양하여 실험 재료로 이용하였다.
배지조건
전엽체 증식에 효과적인 배지를 선발하고자 계대배양하여 증식된 전엽체를 실험의 재료로 사용하였다. 전엽체는 200 mL 배양병당 300 ㎎씩 메스로 곱게 다져 멸균수 1 mL를 넣고 배지에 접종하였으며, 배지는 무기물과 비타민의 농도를 1/4, 1/2, 1배로 달리한 MS 배지(Murashige and Skoog, 1962; sucrose 3%, agar 0.8 g, pH 5.8)와 Knop 배지(sucrose 0.5%, agar 0.8 g, pH 5.8)를 이용하여 8주간 배양하였다. 배양환경은 온도 25±1℃, 광주기 16/8시간으로 조절되었으며, 광량은 30±1.0 μmol·m-2·s-1로 설정하였다. 실험은 각 처리별로 4반복 수행하였다.
전엽체의 생육이 가장 양호하였던 기본 배지를 선발한 후 배지내 sucrose (White sugar, CJ Cheil-Jedang, Korea)의 함량에 따른 전엽체의 증식 조건을 검토하였다. 전엽체의 생육이 가장 양호하였던 MS 배지를 기본으로 sucrose 농도를 0, 1, 2, 3, 4%로 조절하여 조건을 검토하였다. Sucrose 농도별 실험을 제외한 배지의 sucrose 농도는 3%로 조절되었다. 전엽체는 배지종류에 따른 증식 조건 검토와 동일한 방법으로 처리한 후 각 배지에 접종하여 8주간 동일한 조건에서 배양하였다. 배지종류 및 구성물질에 따른 진퍼리고사리의 증식을 측정하기 위하여 각 조건별 배지에서 8주간 증식시킨 전엽체를 대상으로 생체중을 측정하였고, 실체 현미경(SZ51, Olympus, Japan)을 사용하여 전엽체의 형태를 관찰하였다.
토양종류
계대배양한 전엽체를 배지와 분리한 다음 다찌가렌(Hymexazol 30%, Dongbu Agrotech, Korea) 1000배 희석액으로 1시간 동안 침지하여 소독한 후 5회 수세하였다. 수세한 전엽체 1.0 g에 증류수 25 mL를 비커에 넣고 핸드 블렌더(V-8000, Boowon, Korea)로 10초간 분쇄한 후 전엽체는 배양토 표면에 균일하게 접종하여 12주간 배양하였다. 포자체 배양 실험은 배양토당 4반복 수행하였다. 배양토는 원예상토(Hanareum no. 2, Shinsung Mineral Co. Ltd., Korea), 피트모스(Sunshine, Sun Gro Hort., Canada), 펄라이트(Newpershine no. 2, GFC. Co, Ltd., Korea), 마사토(2 ㎜, Samgye Masato, Korea)를 사용하여 조건을 검토하였다. 토양 종류에 따른 전엽체의 증식 효과를 검토하기 위하여 원예상토 단용, 원예상토:펄라이트= 2:1(v:v), 원예상토:마사토=2:1(v:v), 원예상토:피트모스:펄라이트 =1:1:1(v:v:v) 및 원예상토:피트모스:마사토=1:1:1(v:v:v)의 비율로 배양토를 혼용하여 실험에 사용하였다. 배양토는 사각화분 (75×75×75 ㎜, Cosmo Corporation, USA)에 4반복으로 충진한 후 플라스틱 상자(503×335×195 ㎜, SPC532, SH Plastic, Korea)에 배치하였다. 관수는 저면관수를 실시하였으며, 플라스틱 상자를 유리판으로 덮어 습도를 유지하였고, 접종 3주부터 1일 1회 두상관수하여 수정을 유도하였다. 배양환경은 온도 25±1℃, 광주기 16/8시간으로 조절되었으며, 광량은 43±2.0 μmol·m-2·s-1로 설정하였다. 배양토에 접종한 다음 약 12주간 재배 후 포자체 수, 지상부 및 지하부 생체중, 엽수, 엽장, 엽폭, 근수 및 근장을 측정하였다.
통계처리
모든 실험에 사용된 통계분석은 SAS 프로그램(Statistical Analysis System, 9.4 Version, SAS Institute, Cary, NC, USA)을 사용하여 분산분석(ANOVA)을 실시하였고, Duncan’s multiple range test 를 이용하여 p<0.05 수준으로 유의적 차이를 검정하였다.
결과 및 고찰
배지종류에 따른 전엽체의 증식
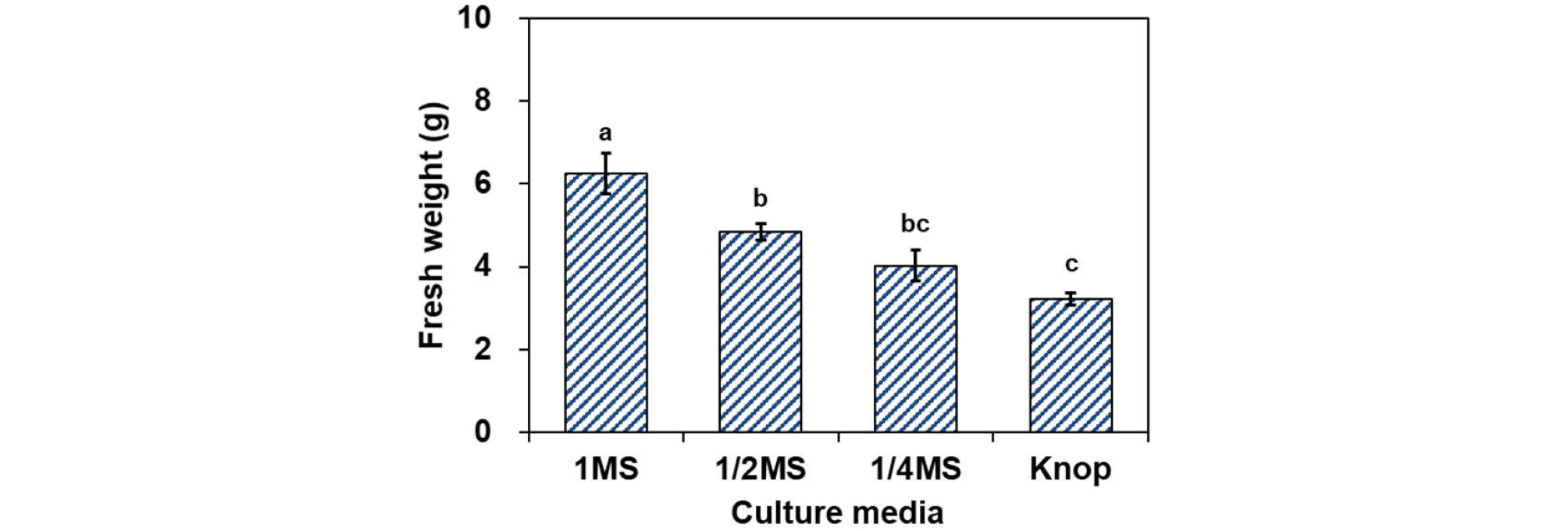
전엽체 증식에 필요한 영양물질의 함량은 양치식물의 종에 따라 차이(Shin and Lee, 2009)를 보이기 때문에, 종에 따라 요구되는 배지의 종류 및 농도 조건이 검토되어야 한다(Cho and Lee, 2017). 본 실험에서는 MS의 농도를 달리한 배지와 Knop 배지에서 8주간 전엽체를 배양하여 증식을 관찰하였다. 그 결과, MS 배지에서 전엽체의 생체중이 가장 많이 증가하였으며, 배지의 농도가 낮아질수록 생체중이 감소하였다(Fig. 1). MS 배지에 배양된 전엽체는 생체중이 6.24 g으로 가장 많이 증가하였고, 1/2MS (4.8 g), 1/4MS (4.0 g), Knop (3.2 g)순으로 생체중이 조사되었다. 전엽체 형태형성의 발달은 MS와 1/2MS 배지에서 정상적으로 관찰되었으며, Knop과 1/4MS 배지에서는 브런치구조가 관찰되어 전엽체의 발달속도가 미진하였다(Fig. 2). Fernández and Revilla (2003)의 연구에 따르면 MS 배지와 같이 무기물 및 비타민이 풍부한 배지는 소포자낭아강(leptosporangiate)에 속하는 양치식물의 건물중을 증가시켰다. 배지에 첨가되는 무기물 중에 칼륨과 황은 결핍시 전엽체의 성장을 저하시키는 요인으로 보고되었다(Laurent and Lefebvre, 1980). 본 연구에서 MS 배지의 농도가 적을수록 전엽체의 생체중이 감소한 결과는 배지 내 무기물의 함량이 감소함에 따라 증식에 요구되는 양분이 부족했던 것으로 판단된다. 따라서 진퍼리고사리 전엽체의 성장을 위해서는 무기물이나 비타민이 풍부한 MS 배지에서 배양하는 것이 효과적일 것으로 판단된다.

Fig. 2.
Cultural response and organ formation from prothallus of Leptogramma pozoi (Lag.) Ching subsp. mollissima (Fisch. ex Kunze) Nakaike cultured on different media. (a) and (e), full-strength MS medium; (b) and (f), half-strength MS medium; (c) and (g), quarter-strength MS medium; (d) and (h), Knop medium; an, antheridium; hg, heart-shaped prothallus; pr, protonema; sg, spatulate-shaped prothallus.
Sucrsoe 농도에 따른 전엽체의 증식
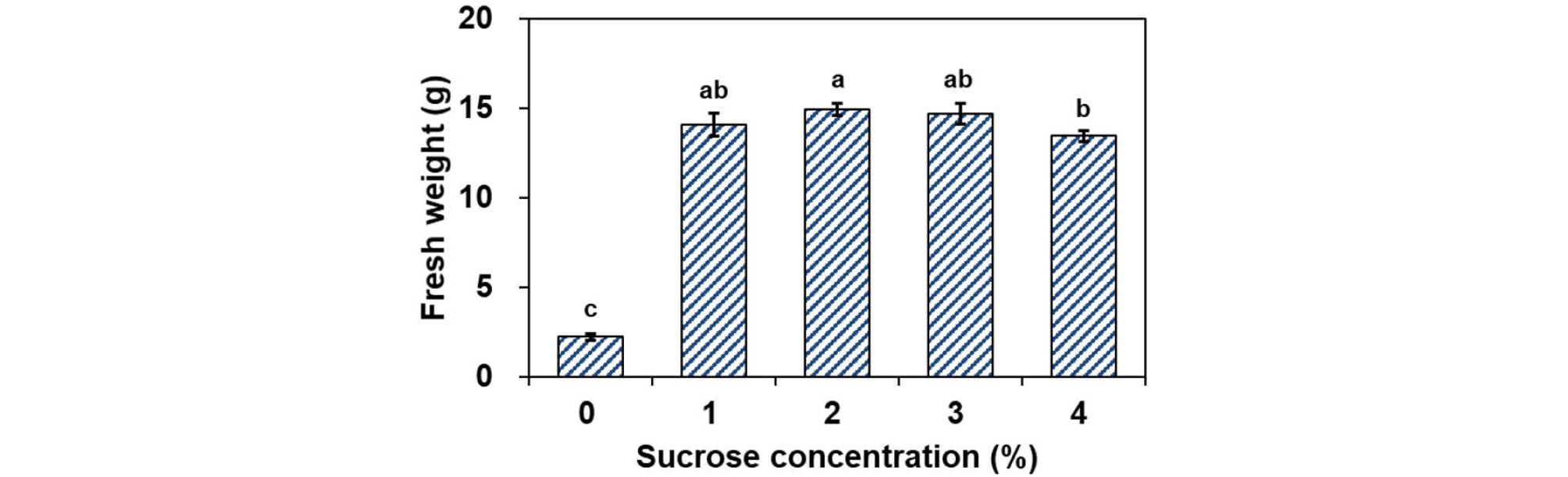
일반적으로 기내배양에서 배지의 sucrose 결핍은 광합성 활성을 억제하여 식물생육을 저해할 수 있으며(Ambrósio and Melo, 2004), 고농도의 sucrose는 노화를 일으키는 것으로 알려져 있다(Hannay and Butcher, 1961). 또한 양치식물에서도 sucrose는 전엽체의 성장에 도움을 주는 탄소원으로 알려져 있다(Fernández and Revilla, 2003). 본 연구에서도 sucrose의 농도가 전엽체의 생육에 미치는 영향을 조사하였다. Sucrose를 첨가한 모든 처리구는 무처리구에 비해 생체중이 유의적으로 증가하였으며, 무처리구는 2.2 g으로 가장 낮았다(Fig. 3). 그중 2% 처리구에서 생체중이 14.9 g으로 가장 많이 증가하였다. 또한 전엽체 형태형성도 하트형 전엽체로 정상발달하였으며, 생식기관인 장정기가 관찰되었다(data not shown).한편 4% 처리구에서는 생체중이 유의적으로 감소하는 경향을 나타냈다. 이러한 결과는 4% 이상의 고농도 sucrose가 생육을 저해하기 때문일 것으로 추정된다. Fernández et al. (1999)에 따르면 sucrose의 농도가 증가할수록 식물기관은 전분과 환원당을 축적하며, 엽록소의 분해가 일어나 광합성은 감소하고 생육이 억제된다고 보고하였다. 이 같은 결과는 전엽체의 증식에 sucrose가 필수적이며, 적정농도가 요구됨을 시사한다.
배양토 조건에 따른 포자체 형성
포자체의 형성은 원예상토와 펄라이트 2:1(v:v)(958.5개), 원예상토와 마사토 2:1(v:v)(978.0개)의 혼용토에서 가장 많이 형성되었다(Table 1 and Fig. 4). 이와 유사한 연구결과는 착생종 양치식물에서 관찰되었는데, 질석 또는 펄라이트를 혼용하여 통기성을 증가시킨 토양에서 가장 많은 포자체 형성을 확인할 수 있었다(Lee, 2000). 따라서 원예상토와 마사토의 혼용은 통기성을 높여 포자체의 형성에 알맞은 생육환경을 조성한 것으로 추정된다. 포자체의 지상부 생체중은 원예상토:피트모스:펄라이트 1:1:1(v:v)에서 가장 우수하였으나, 지하부의 생체중은 혼용토 처리별로 차이를 보이지 않았다. 포자체의 엽수는 원예상토 단용(4.1개), 원예상토:펄라이트 2:1(v:v)(3.5개), 원예상토:마사토 2:1(v:v)(3.8개) 처리구 모두에서 유의한 차이가 확인되지 않았다. 엽장은 원예상토 단용(15.5 ㎜)과 원예상토:피트모스:펄라이트 1:1:1(v:v)(14.7 ㎜)에서 가장 우수하였다. 엽폭은 원예상토:펄라이트 2:1(v:v)을 제외한 혼용토 간 큰 차이는 없었으며, 근수와 근장에서는 혼용토 처리별 유의한 차이가 확인되지 않았다. 토양환경은 식물생육의 주요지표로 여겨지며, 토양의 물리성과 화학성의 변화에 따라 식물생육 전반에 직간접적인 영향을 주는 것으로 알려져 있다(Choi et al., 2011). 따라서 전엽체를 이용하여 포자체를 유도하기 위해서는 토양의 물리성과 화학성을 고려하여 조성하는 것이 중요하며, 본 연구에서 사용된 펄라이트와 마사토는 배수성과 통기성을 증가시키는 인공토양으로 토양 내 물리성을 향상시켜 포자체의 형성을 촉진한 것으로 생각된다. 따라서 진퍼리고사리의 포자체 형성과 우수한 생육을 위해서 원예상토와 마사토를 2:1의 비율로 혼용하여 배양하는 것이 가장 효과적인 토양조성으로 판단된다.
Table 1. Effect of soil types on sporophyte formation and biomass of Leptogramma pozoi (Lag.) Ching subsp. mollissima (Fisch. ex Kunze) Nakaike in vivo
yPot (75 × 75 × 75 ㎜) containing 0.3 L culture medium was used for this experiment.
xMean separation within columns by Duncan's multiple range test, p<0.05.

Fig. 4.
Sporophyte formation of Leptogramma pozoi (Lag.) Ching subsp. mollissima (Fisch. ex Kunze) Nakaike after 12 weeks cultivation according to soil types. (a), Hs1; (b), Hs2-Pr1; (c), Hs2-D1; (d), Hs1-Pt1-Pr1; (e), Hs1-Pt1-D1. Hs, horticultural substrate; Pt, peatmoss; Pr, perlite; D, decomposed granite.
적 요
본 연구는 진퍼리고사리의 전엽체 증식을 위한 배지를 선발하고, 포자체 증식을 위한 적정 배양토를 구명하여 대량생산 체계를 구축하고자 수행되었다. 전엽체 증식연구는 배지종류(1/4, 1/2, MS 배지, Knop 배지), sucrose (0, 1, 2, 3, 4%),의 농도를 달리한 배지에 전엽체 300 ㎎를 각각 접종하여 8주간 배양한 후 전엽체의 생육을 비교하였다. 포자체 형성 연구는 분쇄한 전엽체를 인공토양위에 접종하여 수행하였다. 인공토양은 원예상토, 펄라이트, 마사토의 비율을 다르게 조성하거나 원예상토 단용으로 사용했다. 그 후 접종한 전엽체를 12주간 배양한 다음 포자체 형성 및 생육을 조사하였다. 본 연구의 결과, 기내 전엽체는 2% sucrose를 첨가한 MS 배지에서 생체중과 생육이 가장 우수하였다. 포자체 형성을 위한 배양토 조성 실험에서는 원예상토:펄라이트 2:1(v:v)와 원예상토:마사토 2:1(v:v) 처리구에서 포자체의 형성이 가장 많았으며, 전반적인 생육은 원예상토:마사토 2:1(v:v)가 우수하였다.