서 언
인동과(Caprifoliaceae)의 인동속(Lonicera)은 세계적으로 약 180종이 북아메리카와 유럽, 아시아, 북아프리카 등에 분포하며, 관목 또는 소교목이다(Rheder, 1903; Naugžemys et al., 2007). “Honeysuckles”이라고도 알려져 있는 인동속 식물은 관상용으로 개발되거나 사용되고 있으며, 중국 등에서는 일부 종들은 항염 또는 소염제 등 약용으로 사용되기도 한다(Ryuk et al., 2012; Theis et al., 2008; Yuan et al., 2012). 인동속 중 우리나라에 자생 종은 각시괴불나무와 청괴불나무, 섬괴불나무, 올괴불나무 등 15종이 보고 되어 있다(Flora of Korea Editorial Committee, 2007). 그 중 각시괴불나무(Lonicera chrytsantha Turcz. Ex Ledeb)는 낙엽활엽관목으로 주로 중부이북, 청괴불나무는 황해도 이남, 올괴불나무는 제주도를 제외한 전국에 분포하며, 섬괴불나무는 울릉도에만 국소적으로 분포하는 희귀수종이다. 우리나라에 분포하는 인동속은 덩굴성이거나 관목으로 백색 또는 연황색, 황색, 연홍색, 홍색 등 다양한 색상의 꽃을 피우고, 향기가 있으며, 겨울철까지 열매가 달려있어 종들이 많아 관상용으로 적합하며, 약용으로도 이용되는 유용한 자원식물이다(NKISBS, Korea National Arboretum, 2016). 국내 자생 인동속의 수종들을 관상용 또는 약용으로 활용하기 위해서는 수종 별 많은 수의 개체 확보가 필요하고, 또한 대량증식을 위한 연구가 필요하다.
종자를 이용한 유성번식은 많은 양의 개체를 한번에 얻을 수 있는 방법이지만, 종자 휴면을 가지고 있는 종들은 휴면을 타파하고 발아에 적합한 환경을 유지해야 한다(Ko et al., 2017; Lee et al., 2012). 따라서 종자의 휴면유형 분류와 발아특성을 파악하는 것은 종자를 이용한 유성증식을 위해서 필수적인 요소이다. 생태학적인 관점에서 종자의 휴면은 식물이 생육에 적합한 환경이 될 때까지 발아를 억제하는 기작으로 대상 종의 환경에 대한 적응을 이해하는 데에 중요한 역할을 한다(Choi et al., 2018; Finch-Savage and Leubner-Metzger, 2006; Geneve, 2003). 종자 휴면 기작은 Baskin and Baskin (2004)에 의해 크게 5가지로 분류되었는데, 종피의 불투수성으로 인하여 발아가 억제되는 물리적 휴면(physical dormancy, PY)과 종자 내 발아 억제물질로 인하여 발아가 억제되는 생리적 휴면(physiological dormancy, PD), 탈리시점에 미숙배를 가지는 형태적 휴면(morphological dormancy, MD), 형태적 휴면과 생리적 휴면이 동시에 나타나는 형태생리적 휴면(morphophysiological dormancy, MPD), 물리적 휴면과 생리적 휴면이 동시에 나타나는 조합휴면(combinational dormancy, PY+PD)으로 휴면의 원인에 의해 분류된 것이다. 종자의 휴면은 일반적으로 종 특이적인 기작이지만 같은 분류계급(과와 속)내에서도 대상 종의 지리적 분포와 생태적 특성에 의해 종류와 정도가 다르게 나타나기도 한다.
일반적으로, 인동속(Lonicera) 수종들의 종자는 모수로부터 탈리되는 시점에 미숙배를 가진다고 알려져 있다(Martin, 1946). 따라서, 인동속 종자들은 형태적 휴면 또는 형태・생리적 휴면을 단일 또는 복합으로 가지고 있다(Hidayati et al., 2000a; Hidayati et al., 2000b). 북아메리카 대륙에 분포하는 4종의 인동속 종자들의 휴면을 분류한 결과, Lonicera japonica Thunb는 배 발달에 상대적 고온처리와 휴면타파에 저온 또는 고온 습윤처리가 필요한 non-deep simple MPD를 가지고 있으며, L. fragrantissima Lindl. & Paxton는 배발달을 위한 고온습윤처리와 휴면타파를 위한 고온습윤 후 저온습윤 처리가 필요한 deep simple MPD, L. maackii (Rupr.) Maxim와 L. morrowii A. Gray종자의 절반은 non-deep simple MPD를, 나머지 절반은 MD만을 가지고 있는 것으로 보고된 바 있다(Hidayati et al., 2000b). 그리고 일본에 자생하는 L. caerulea var. emphyllocalyx의 종자는 MD만을 가지고 있다고 보고되었다(Phartyal et al., 2009).
인동속 수종들의 종자 휴면유형 분류나 발아특성에 대한 연구는 북아메리카와 일본 지역에 분포하는 일부 종들에 대해 수행된 바 있지만, 우리나라에 자생하는 수종들에 대한 연구는 미비한 실정이다.
따라서 본 연구는 우리나라에 자생 분포하는 각시괴불나무에 대해 지금까지 연구되지 않은 종자의 휴면유형을 분류를 통해서 유용자원으로서의 활용을 위한 대량증식법을 개발하고 국내 및 외국에 자생하는 인동속 식물들 중에서 각시괴불나무의 종자 휴면의 진화적, 생태학적, 계통분류학적인 연구를 위한 기초 자료를 수집하기 위하여 수행되었다.
재료 및 방법
공시재료
본 연구의 실험에 사용된 각시괴불나무 열매는 2018년 8월 경기도 양평군 소재 국립수목원 유용식물증식센터 포지에 보유중인 20개체 이상의 모수에서 무작위로 약 3,000 개 이상 채취하였다. 채취된 열매들은 과육을 제거하고 정선 후 통풍이 잘되고 서늘한 조건의 상온에서 14일간 건조하였다. 건조된 종자들은 플라스틱 용기에 밀봉하여 2018년 8월 28일 실험 시작까지 냉장(4℃) 보관하였다.
수분흡수 실험
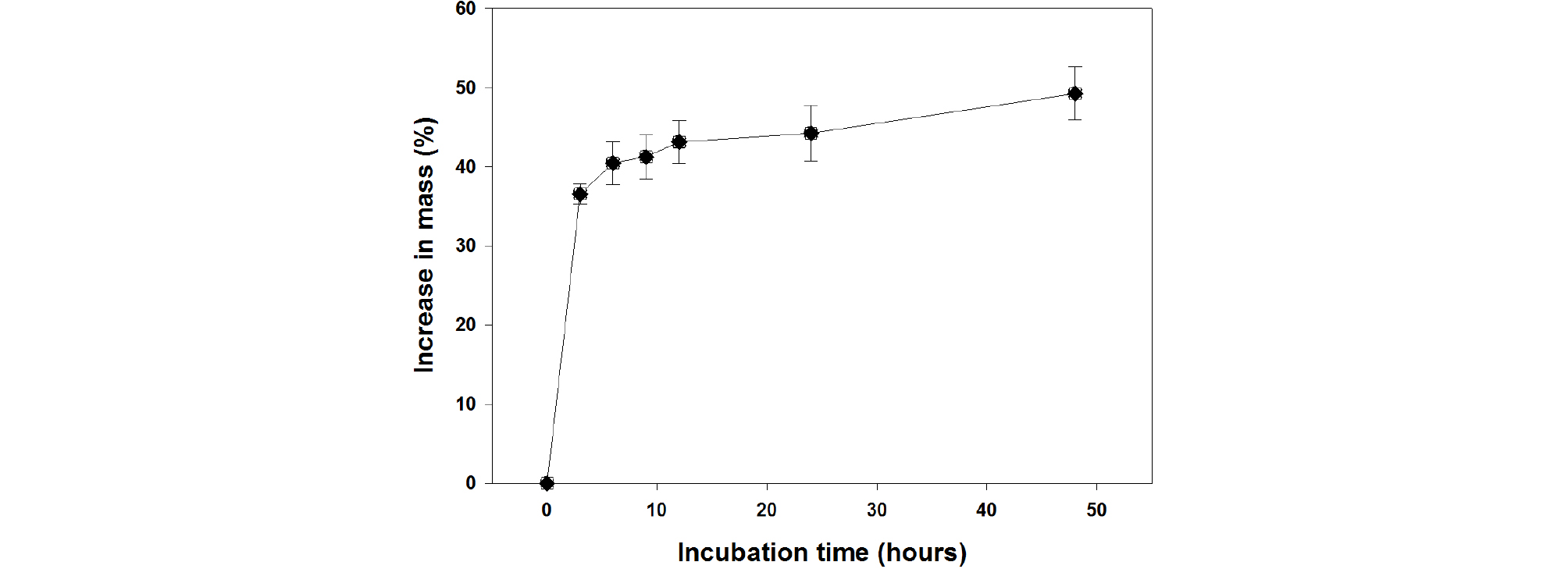
각시괴불나무 종자의 3, 6, 9, 12, 24, 48 시간 동안의 수분흡수율을 계산하여 약 20% 이하의 불투수성을 가지는 물리적 휴면 유무를 구명하기 위하여 수분흡수 실험을 수행하였다. 20립의 종자를 90x15 mm Petri dish (Cell Culture Dish, SPL lifesciences Co. Ltd, Gyeonggi-do, Korea)에 2장의 여과지(Whatman No.2, GE Healthcare, Buckinghamshire, UK)를 깔고 멸균수를 첨가한 후 3반복으로 치상하여 상온에서 배양하였다. 종자의 초기 건중량을 측정하였고, 배양 후 3, 6, 9, 12, 24, 48 시간 간격으로 생중량을 측정하였다. 종자의 수분 흡수율은 아래의 공식으로 측정하였다(Baskin and Baskin, 2003).
Ws = [(Wh – Wi)/Wi] × 100
Ws: 무게 증가율, Wh: 각 시간별 생중량 ,Wi: 종자 초기 건중량
종자 내부 관찰
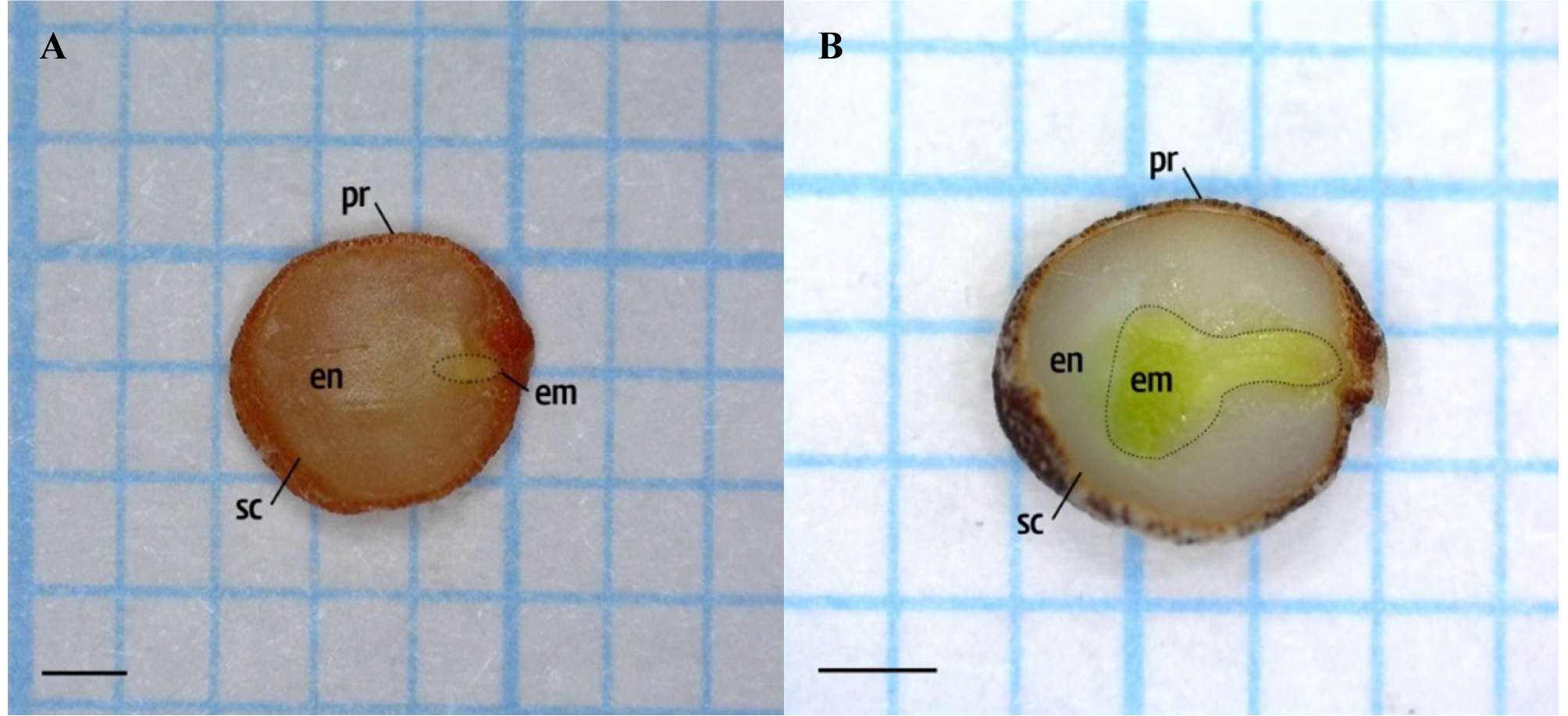
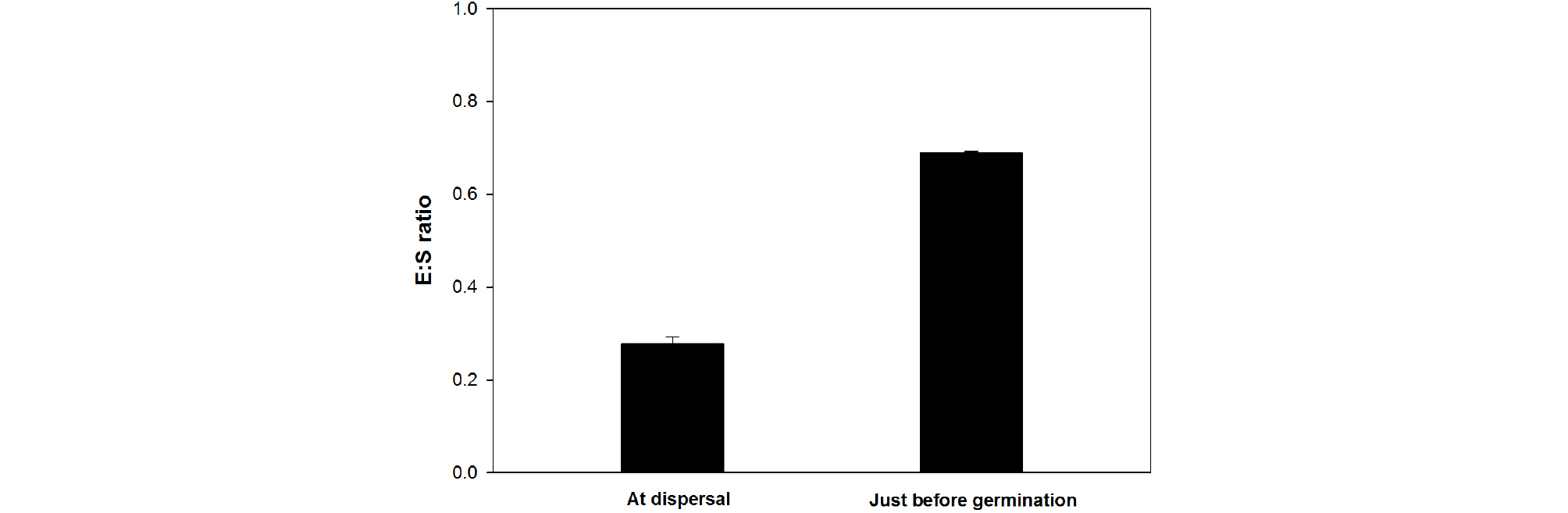
종자의 형태적휴면은 탈리시점과 종자의 발아 직전의 배의 크기의 증가 유무로 판단된다(Baskin and Baskin, 2004). 따라서 미숙배의 유무를 확인하기 위하여 각시괴불나무 종자를 양날면도칼(Stainless blade, Dorco, Seoul, KR)을 이용하여 반으로 절단하여 USB현미경(AM 3111 Dino-Lite premier, AnMo Electronics Co., Taiwan)을 사용하여 배와 배유의 단면을 60배율로 관찰하였다. 종자의 탈리 시점과 유근이 돌출한 시점의 배의 형태와 크기를 측정하였고, 정확한 배 신장 여부를 확인하기 위하여 E:S ratio (Embryo/seed ratio)를 계산하였다.
온도에 따른 발아 특성
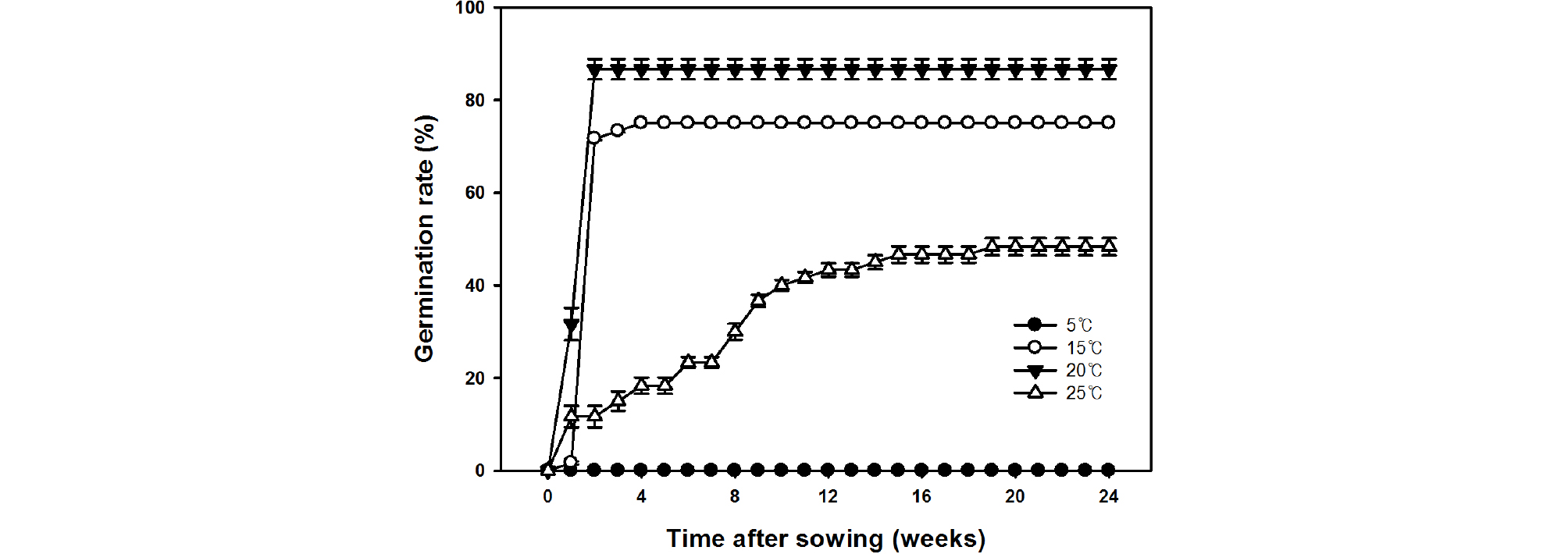
종자의 생리적휴면은 일반적으로 모든 온도조건에서 30일 이내에 발아가 이루어지지 않으며, 저온 및 고온 층적처리로 타파된다(Baskin and Baskin, 1998; Baskin and Baskin, 2004; Nikolaeva, 1977). 30일 이내의 발아유무와 휴면타파를 위해 필요한 온도조건을 알아보기 위하여 냉장 보관된 종자들을 치상하기 전 NaOCl 2% 용액에 5분간 침지 소독한 뒤 멸균수로 5회 이상 수세한 후 90x15 ㎜ Petri dish에 여과지 2매를 깔고 증류수를 첨가한 뒤 20립씩 3반복으로 치상하였다. 온도에 따른 발아특성을 알아보기 위하여 종자를 5, 15, 20, 25℃의 항온으로 설정된 생장상(WIM-R L4, Daihan scientific Co. Ltd, Wonju, Korea)에 배양하였다. 생장상 내부의 광도는 약 15-20 µmolm-2・s-1, 광주기는 16시간 명 조건을 유지하였다. 배양 후 매주 발아율을 조사하였으며, 발아는 유근이 1 ㎜ 이상 돌출된 것으로 하였다. 실험 기간 동안 여과지가 마르기 전에 증류수를 보충하였다. 발아 조사 시 부패한 종자들은 제거하였고 발아율 계산에서 제외하였다.
결과 및 고찰
수분흡수 실험
수분흡수 테스트 결과, 각시괴불나무 종자는 배양 24시간 후부터 40% 이상의 수분흡수율을 나타냈으며 48시간 후 최종 수분흡수율은 49.2%였다(Fig. 1). 물리적 휴면의 경우 보통 두꺼운 종피나 세포의 책상조직층의 불투수성에 의해서 수분흡수가 차단되며(Baskin and Baskin, 1998), 12시간 이내에 20% 이상의 흡수율을 보이는 종자들은 물리적 휴면을 가지고 있지 않다고 판단한다(Baskin and Baskin, 2003). 따라서 각시괴불나무 종자는 불투수성에 의한 물리적 휴면은 가지지 않는 것으로 확인되었다.
온도에 따른 발아특성
온도에 따른 발아특성을 확인한 결과, 5, 15, 20, 25℃에서 최종발아율은 각각 0, 75.0, 86.7, 48.3%로 조사되었다(Fig. 2). 20℃에서 최종발아율이 가장 높게 나타났으며, 5℃에서는 발아가 전혀 진행되지 않았다. 25℃에서는 최종발아율이 48%로 15와 20℃에 비해서 절반 가량 낮게 조사되었다(Fig. 2). 일반적으로 종자 발아가 적정환경에서 30일 이내에 이루어지지 않으면 생리적 휴면이 있는 것으로 판단한다(Baskin and Baskin, 1998; Baskin and Baskin, 2004; Nikolaeva, 1977). 각시괴불나무 종자는 5℃를 제외하고 15, 20, 25℃에서 발아가 1주차부터 시작하여 2주차에는 발아율이 각각 71.6, 86.7, 11.7%였다. 5℃와 25℃를 제외하고 3주이내에 발아율이 70% 이상 높게 나타났기 때문에 각시괴불나무 종자는 생리적 휴면을 가지지 않은 것으로 판단되었다. 또한 최종 발아율이 15, 20℃에서 각각 75.0, 86.7%였으며, 25℃에서는 15℃보다 1주차 발아율이 높게 나타났지만 최종 발아율은 절반 가량 낮았다. 따라서 각시괴불나무 종자는 배 신장 및 발아가 상대적 고온(15℃-20℃)에서 이루어지는 것으로 판단되며, 증식을 위한 최적온도는 최종 발아율이 가장 높고 발아 소요일수가 가장 짧은 20℃인 것으로 판단된다.
종자 배관찰
종자의 내부 단면을 관찰한 결과, 각시괴불나무 종자는 탈리 시점에 미숙배를 가지고 있었으며 발아 전까지 배의 신장이 관찰되었다(Fig. 3). 종자의 초기 E:S ratio는 0.28±0.01 mm이었으며, 발아직전의 E:S ratio는 0.41±0.05 mm로 탈리 시점부터 발아까지 약 46%가 증가하였다(Fig. 4). 이전 연구들에서 인동속 수종의 경우 주걱형의 미숙배를 가지는 것으로 보고되었다(Hidayati et al., 2000a; Hidayati et al., 2000b; Martin, 1946). 미숙배를 가지는 종자들은 형태적 휴면(MD) 또는 형태생리적 휴면(MPD)을 가지고 있다. 탈리 후 발아 전까지 일정 크기 이상 배가 신장해야 발아를 하는데, 배의 신장부터 발아까지 30일 이내에 이루어지는 경우를 형태적 휴면(MD)이라고 하며(Baskin and Baskin, 1998; Baskin and Baskin, 2004), 미숙배를 가지고 있는 종자들이 적절한 환경 내에서도 30일 이내에 발아가 이루어지지 않거나 고온습윤, 저온습윤의 단일 또는 복합 처리가 필요한 경우를 형태생리적 휴면(MPD)이라고 한다(Baskin and Baskin, 2004). 각시괴불나무 종자의 경우 미숙배를 가지며, 발아 전 배의 신장이 이루어지지만 생리적 휴면이 없기 때문에 형태적 휴면만을 가지는 것으로 판단된다.
겉씨식물과 속씨식물의 종자휴면의 진화에 있어 미숙배 크기의 증가는 각 종들의 종자휴면의 진화 순서 및 과정을 파악하거나 계통분류에 있어 분화 순서를 판단하는 기준이 되는 중요한 지표이다(Baskin and Baskin, 1998; Forbis et al., 2002). 계통발생학적 분포도에서 같은 속에서 상대적으로 먼저 분화되어 존재했던 종들의 종자는 대부분 미숙배를 가지고 있기 때문에, 형태적 휴면은 종자의 휴면유형 중에서 가장 원시적인 형태로 판단된다(Finch-Savage and Leubner-Metzger, 2006). 종자휴면이 진화를 거듭하면서 미숙배들은 크기가 커졌으며, 완전히 자란 형태의 배를 가진 종자들은 비휴면 종자로 진화되었다. 또한, 형태적 휴면을 가진 종자들은 생리적 휴면을 추가로 얻으면서 형태생리적 휴면을 가지거나 그 후 배가 자라면서 형태적 휴면을 잃은 생리적 휴면 종자가 되었다(Finch-Savage and Leubner-Metzger, 2006). 따라서 같은 속 내에서 형태적 휴면을 가진 종자들은 계통발생학적 측면에서 가장 원시적인 휴면유형을 유지하며 다른 형태생리적, 생리적 휴면을 가진 종들에 비하여 더 일찍 분화 되었다고 판단된다. 국내 자생하는 각시괴불나무의 경우에 다른 형태생리적 휴면을 가진 국내 및 외국 자생 인동속 식물들과는 다르게 물리적, 생리적 휴면을 가지지 않고 형태적 휴면만을 나타내고 있다. 따라서 국내 자생하는 인동속 식물들 중에서 각시괴불나무는 계통발생학적으로 더 원시적인 종자의 휴면유형을 유지하고 있으며, 종자의 휴면유형이 잘 보존되어 있는 것으로 판단된다.
결론적으로 국내 자생하는 각시괴불나무 종자의 경우 물리적 휴면과 생리적 휴면은 가지고 있지 않으며, 탈리 시점에 미숙배를 가지고 발아를 위해서 배가 신장하는데 시간이 필요한 형태적 휴면을 가지는 것으로 판단되었다. 또한 종자의 발아 적온은 최종 발아율이 가장 높은 20℃인 것으로 판단되었다. 따라서, 각시괴불나무 종자는 모수에서 탈리되어 별도의 추가적인 저온 및 고온 층적처리 없이 상대적 고온(20℃)에서 배가 신장하여 발아하며, 고온조건을 받게 되면 배 신장 및 발아율이 감소될 것으로 판단되었다. 이러한 결과는 국내 자생 인동속 식물의 단순한 발아 특성 연구가 아닌 이전에 연구되지 않은 국내 자생 각시괴불나무의 종자 휴면의 정확한 분류를 통한 대량증식법 개발과 인동속 식물 중에서 국내 자생하는 각시괴불나무가 가지는 종자 휴면의 진화적, 생태학적, 계통분류학적 연구에 있어 기초자료로 활용될 수 있을 것으로 판단된다.
적 요
본 연구는 각시괴불나무 종자의 휴면유형과 발아특성을 구명하기 위하여 수행되었다. 수분흡수 실험결과, 각시괴불나무 종자는 수분흡수가 원활히 이루어졌다. 따라서, 물리적 휴면은 가지지 않는 것으로 판단된다. 각시괴불나무 종자는 탈리 시점에 미숙배를 가지고 있으며, 발아직전까지 배/종자 비율이 약 46% 증가하였다. 온도실험결과, 5℃에서는 발아가 전혀 이루어지지 않았다. 20℃에서는 파종 후 1주부터 발아가 시작되었으며 최종 발아율은 2주차에 86.7%였다. 15℃에서는 파종 후 2주부터 발아를 시작하였으며, 최종 발아율은 4주차에 75.0%였다. 25℃에서 파종 후 1주부터 발아가 시작되었으며 최종 발아율은 19주차에 48.3%였다. 결론적으로, 각시괴불나무 종자의 발아를 위한 최적온도는 가장 높은 최종 발아율과 가장 짧은 평균 발아 일수를 나타낸 20℃이다. 각시괴불나무 종자는 5℃를 제외한 모든 온도에서 4주 이내에 발아하였기 때문에 생리적 휴면은 관찰되지 않았다. 따라서, 각시괴불나무 종자는 오직 형태적 휴면만을 가지는 것으로 판단되었다.