서언
재료 및 방법
실험 재료와 추출물의 제조
세포배양
세포생존율 분석
Tunel 분석
Caspase-3 활성도 측정
FACS 분석
폴리페놀 함량 분석
플라보노이드 함량 분석
통계처리
결과 및 고찰
천초근의 ROS 생성 억제 효과 및 폴리페놀, 플라보노이드 함량
천초근 에탄올 추출물의 HCT-116 세포주 사멸 효과
천초근 에탄올 추출물의 HCT-116 세포주에 대한 caspase-3 활성화, DNA 단편화 유도활성
적요
서언
우리나라에서 대표적인 만성질환으로 알려져 있는 암은 신체 조직을 구성하고 있는 세포가 제한 없이 증식되어 악성종양을 형성하게 되는 질병으로서, 산업발달과 식생활의 변화 또는 유전적인 요인에 의해 발병하게 된다(Lewis et al., 2005).
대장암은 우리나라뿐만 아니라 서양에서도 흔히 발생하는 악성종양중 하나이며 여성보다 남성에서 발생률이 더 높은 것으로 알려져 있다(Kim et al., 2013). 대장암을 치료하는 방법으로, 일반적인 방법인 수술 이외에 화학요법과 방사선요법 등이 시행되고 있으나 이는 면역기능저하, 탈모, 신장독성, 심장독성과 같은 여러 부작용을 야기할 수 있다고 알려져 있다(Shariati et al., 2010; Andersen et al., 2006).
이러한 이유로 부작용이 없고 항암효과를 가지고 있는 천연 자원 소재의 탐색과 개발이 요구되며, 이를 이용한 기능성 식품 또는 의약품을 개발하는 연구가 활발하게 진행되고 있다(Shin et al., 2004; Kim et al., 2012; Kwon et al., 2011).
산화스트레스는 건강에 쉽게 영향을 미칠 뿐만 아니라, 질병에 쉽게 관여한다고 알려져 가장 많이 연구되고 있는 분야중 하나로 알려져 있고(Lee et al., 2013), 악성 종양의 원인들 중 하나로 알려져 있는 활성산소는 정상세포에게 영향을 끼쳐 암 또는 기능장애를 유발하게 된다고 알려져 있다(Kim and Kim, 2018).
천초근(Rubiae radix)은 꼭두서니(Rubia akane Nakai)의 뿌리를 건조한 것으로, 우리나라에서 예로부터 어혈을 없애고 지혈작용을 하는 것으로 알려져 다양하게 이용되었다(Kim et al., 2012; Bae et al., 2005).
이와 같은 이유에 의해 최근 항산화효능을 가진 천연 자원 소재를 찾기 위해 여러 분야에서 연구가 진행되고 있다(Woo et al., 2018; You and Moon, 2018; Sim et al., 2017; Jeong et al., 2017).
여러 연구에 따르면, 천초근 추출물은 human promyelocytic leukemia(전골수구백혈병) 세포의 증식을 세포자멸사(apoptosis)과정을 통해 억제시킨다고 알려져 있으며(Choi et al., 2008), Bacillus cereus와 Pseudomonas aeruginosa같은 식중독균의 증식을 억제한다고 알려졌다(Bae et al., 2005). 현재까지 천초근 에탄올 추출물을 이용하여, 대장암을 억제할 수 있는 효능에 대한 연구가 이루어지지 않았다. 따라서 본 연구는 천초근 물 추출물과 에탄올 추출물을 이용하여 대장암 세포에 대한 항암효능과 항산화 효능이 있는지 알아보고자 하였다.
재료 및 방법
실험 재료와 추출물의 제조
본 연구에 사용한 천초근은 꼭두서니과(Rubiaceae)에 속하는 Rubia akane Nakai의 뿌리로서 2015년 5월 27일에 전남 완도(위도 34.16’60”N, 경도 126.87’87”E)에서 채취하였으며, 목포대학교 한약자원학과 김휘 교수님의 식물학적 동정을 거쳤다. 실험에 사용한 시료의 확증표본(TKM-2097)은 한약진흥재단 한약자원본부에 보관하고 있다. 천초근은 멸균수로 수세 한 뒤, 50℃ 조건에서 건조기를 이용하여 일주일간 건조하였다. 건조된 천초근은 분쇄하여, 증류수 또는 에탄올을 칭량한 시료 무게의 10배를 넣고 환류 냉각추출방법을 통해 각각 물추출은 100℃ 조건에서, 에탄올 추출은 70℃ 온도에서 3시간, 3회 반복하여 추출하였다. 추출물은 filter paper (Thermo, Waltham, MA, USA)를 이용하여 여과하고, 여과액을 동결 건조하여 시료를 PBS에 녹인 뒤 사용하였다.
세포배양
RAW 264.7 그리고 HCT-116 세포주는 한국세포주은행(KCLB, Seoul, Korea)에서 분양받아 사용하였다. Dulbecco’s modified Eagel’s medium, DMEM (Thermo, Waltham, MA, USA)에 10% FBS (fetal bovine serum), 1% penicillin/streptomycin을 첨가하여 사용하였고. 37℃, 5% CO2 조건에서 배양하고 유지하였다.
세포생존율 분석
세포생존율은 CellTiter 96® AQueous One Solution Cell proliferation assay kit (Promega, Fitchburg, WI, USA)를 사용하였으며, 제조사의 프로토콜에 따라서 측정하였다. HCT-116 세포를 96 well plate에 5×104 cells/㎖ 농도가 되도록 분주한 뒤 37℃, 5% 배양기에서 24시간 배양한 후 천초근 에탄올 추출물을 각각 31.3, 62.5, 125, 250, 그리고 500 ㎍/㎖ 농도로 24시간 동안 처리하였으며, MTS 시약 20 ㎕를 넣고 2시간 동안 배양한 후 microplate reader Infinite® 200 PRO (TECAN, Mannedorf, Switzerland)를 이용하여 490 ㎚에서 흡광도를 측정하였다. 세포생존율은 정상대조군에 대한 생존율로 표시하였고 이에 따라 추출물들의 암세포 사멸효과를 측정하였다.
Tunel 분석
Tunel 분석은 DeadEnd™ Fluorometric TUNEL System (Promega, Fitchburg, Wisconsin, USA)을 사용하였으며, 제조사의 프로토콜에 따라서 수행하였다. HCT-116 세포를 12 well plate에서 cover slip 위에 5×105 cells/㎖ 농도가 되도록 분주한 뒤, 37℃, 5% 배양기에서 24시간 배양했다. 배양된 세포에 천초근 에탄올 추출물(ERA)을 24시간동안 처리하였다. 그 후 10% neutralized buffered formalin (NBF)로 4℃에서 20분 동안 고정하였고, phosphate buffered saline (PBS)로 2번 씻어주었다. 다음 0.2% Triton X-100 in PBS 용액으로 5분간 투과화한 뒤 PBS로 2번 씻어주었다. 남은 액체가 없도록 모두 제거하고 Equilibration buffer를 5분간 처리하였으며 100 ㎕ rTdT incubation buffer를 처리하고 37℃에서 1시간 동안 배양하였다. 그 후 2×SSC buffer를 처리하고, PBS로 2번 씻은 뒤 Prolong™ Gold antifade mountant with DAPI (Thermo, Waltham, MA, USA)로 봉입하여 Epi-fluorescence microscope (Carl Zeiss, Oberkochen, Germany)를 이용해 형광 정도를 관찰하였다.
Caspase-3 활성도 측정
Caspase-3 의 활성도는 Caspase-3 colorimetric detection kit (Enzo, Farmingdale, NY, USA)를 이용해 실험을 진행했다. HCT-116 세포는 PBS로 세척한 뒤 Pierce™ protease and phosphatase inhibitor mini tablets (Thermo, Waltham, MA, USA)가 포함된 RIPA cell lysis buffer 2 (Enzo, Farmingdale, NY, USA)로 1시간 동안 용해하였다. 세포용해액은 원심분리기로 4℃, 13,000 × g 조건에서 10분간 원심분리 하였고, 단백질 농도를 bradford assay를 이용하여 측정하였다. 총 20 ㎍의 단백질을 사용해 제조사가 제공한 프로토콜에 따라 실험을 진행했다.
FACS 분석
FACS를 이용한 분석에는 annexin V-FITC apoptosis detection kit (Enzo, Farthingale, NY, USA)와 DCFDA cellular ROS detection assay kit (abcam, Cambridge, England)를 사용했다. 세포에 천초근 에탄올 추출물 처리 후 유도되는 apoptosis의 비율을 구하기 위해 제조사에서 제공한 protocol에 따라 Annexin V-FITC와 PI 시약으로 염색시켰으며, 마찬가지로 H2O2 처리에 따른 활성산소종을 확인하기 위해 DCFDA 시약으로 염색하였다. 염색된 세포는 CytoFLEX (Beckman clulter, Indianapolis, IN, USA)를 이용해 분석하였다.
폴리페놀 함량 분석
총 페놀 함량은 Folin-Ciocalteau 시약을 이용하여 Folin과 Denis (1912)의 방법을 일부 변형시켜 측정하였다. 표준물질의 검량선 작성을 위해 gallic acid를 사용하였으며, 각각 추출물에 Folin-Ciocalteu's phenol solution을 각각 160 ㎕를 첨가하고, 3분간 상온에서 반응시킨 뒤 10% Na2CO3 용액을 160 ㎕를 첨가하여 1시간 동안 반응시켰다. 다음 실온에서 10,000 rpm, 10분 동안 원심분리 하였으며 상등액을 microplate reader Infinite® 200 PRO (TECAN, Mannedorf, Switzerland)를 이용하여 750 ㎚에서 흡광도를 측정하였다.
플라보노이드 함량 분석
각각 추출물의 플라보노이드 함량은 96 well plate에 농도별 시료 10 ㎕를 넣고, 10% aluminum nitrate와 1 M potassium acetate를 각각 4 ㎕, methanol 82 ㎕를 첨가하였다. 40분간 암소 반응 한 뒤 microplate reader Infinite® 200 PRO (TECAN, Mannedorf, Switzerland)를 이용해 415 ㎚에서 흡광도를 측정하였다. 표준물질의 검량선 작성을 위해 rutin을 이용하였다(Moreno et al., 2000).
통계처리
통계처리는 평균 ± 표준편차(mean ± SD)로 나타냈다. 유의성을 검정하기 위해 SPSS (Statistical Package for Social Science Inc., Chicago, IL, USA) 통계 프로그램을 사용하였다. 일원변량분석(one way ANOVA)을 실시하였으며, 유의성이 있는 경우 p < 0.05 수준에서, Duncan's Multiple Range Test (DMRT)를 실시하였다.
결과 및 고찰
천초근의 ROS 생성 억제 효과 및 폴리페놀, 플라보노이드 함량
WRA(천초근 물 추출물)와 ERA(천초근 에탄올 추출물)의 폴리페놀(Polyphenol) 및 플라보노이드(Flavonoid) 함량을 알아보기 위해 실험을 진행하였을 때, WRA는 폴리페놀이 14.50 ± 0.86 ㎎/g, 플라보노이드가 11.81 ± 1.30 ㎎/g이 포함되어있는 것으로 나타났다.
반면 ERA는 폴리페놀이 45.77 ± 2.03 ㎎/g, 플라보노이드가 22.82 ± 1.33 ㎎/g으로 WRA에 비해 각각의 함량이 조금 더 높은 것으로 확인되었다(Table 1).
폴리페놀은 식물에서 흔히 발견할 수 있는 화합물로, 식물의 대사에 의해 형성되며 항염증, 항당뇨, 항비반 등 여러 질병에 대한 효능을 가지고 있음이 밝혀져 있다(Pandey and Rizvi, 2009; Horakova, 2011).
ERA의 폴리페놀 및 플라보노이드 함량은 각각 45.77 ± 2.03 ㎎/g, 22.82 ± 1.33 ㎎/g으로, Kwon et al. (2014)에 의해 알려진 모링가(Moringa oleifera Lam.) 잎 에탄올 추출물(폴리페놀; 40.72 ± 1.53, 플라보노이드; 10.03 ± 0.30)과 비교하여 조금 더 높은 것을 확인할 수 있었으며, 모링가 잎은 β-carotene, 플라보노이드 및 폴리페놀 함량이 높아 항산화 제품 소재로 매우 널리 이용되고 있기 때문에(Kwon, 2014; Anwar, 2007), 천초근 추출물 또한 추가 실험을 통해 항산화제로 이용될 수 있을 것이라고 사료된다.
다음으로 각각 추출물의 ROS (reactive oxygen species)억제 효과를 확인하기 위해 실험을 진행하였다. RAW 264.7 세포주에 각각 추출물을 여러 농도(125, 250, and 500 ㎍/㎖)로 30분 동안 전 처리한 뒤, 500 μM H2O2를 24시간동안 처리하여 ROS 생성량을 flow cytometry로 분석했다.
WRA는 H2O2에 의해 증가된 ROS를 억제하지 못했으며(Fig. 1A), ERA는 H2O2 (99.97%)와 비교하여 500 ㎍/㎖ 농도에서 34.39%까지 ROS 생성을 억제하였다(Fig. 1B). ROS는 세포 내부 대사에 의해 생성되며, 세포 분화와 유전자 발현 등에 관여 한다(Rhee et al., 2006).
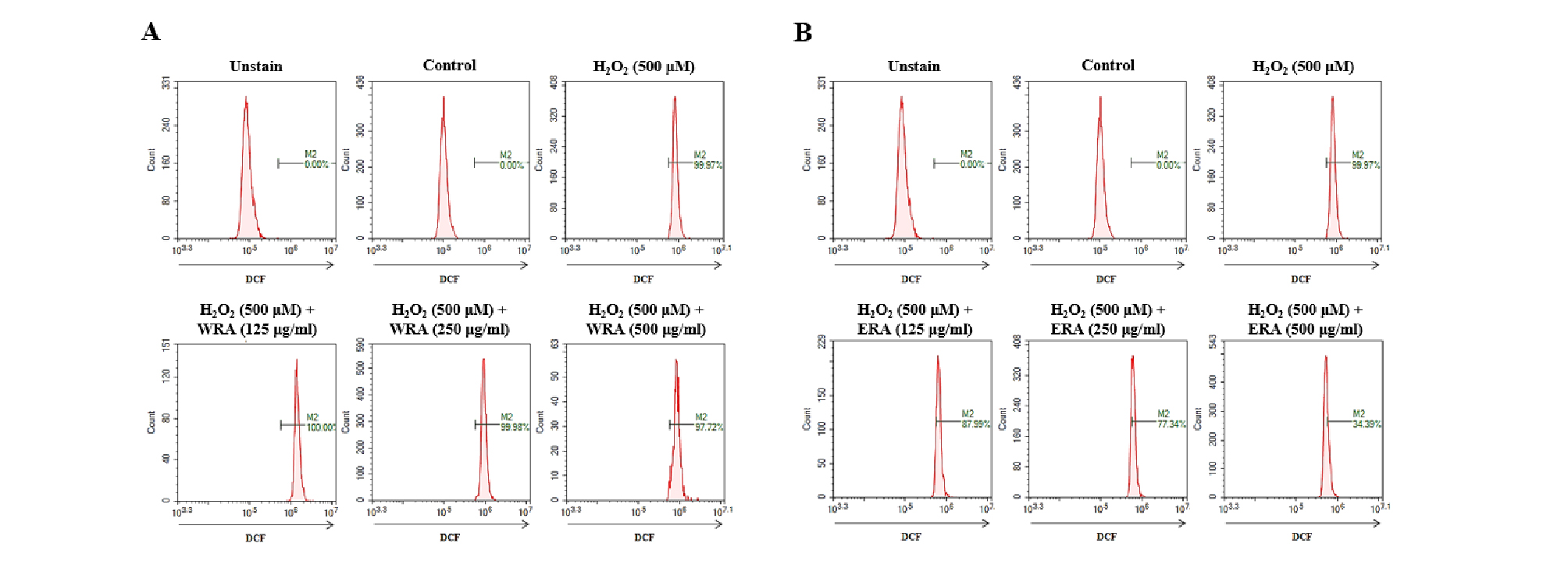
Fig. 1.
Effect of extracts on H2O2-induced ROS generation in RAW 264.7 cells. (A-B) WRA; water extract of Rubiae radix, ERA; ethanol extract of Rubiae radix. After pretreatment with iridin for various concentration (125, 250, and 500 ㎍/㎖), RAW 264.7 cells were treated with 500 μM H2O2 for 24 h. ROS was measured by flow cytometry. Representative images were taken from at least three independent experiments.
과도한 ROS생성은 세포자멸사를 유도할 뿐만 아니라, 염증세포의 응집을 유도하여 염증반응을 일으키는 요인으로 알려져 있다(Kang, 2013; Mittal et al., 2014).
이에 따라 ERA는 H2O2에 의해 증가된 ROS 생성을 억제하는 것으로 판단되며, 결과를 종합하면 WRA 보다 ERA가 항산화 효능이 높은 것으로 나타났다.
천초근 에탄올 추출물의 HCT-116 세포주 사멸 효과
대장암세포 사멸효과를 in vitro 수준에서 확인하기 위해 대장암 세포주인 HCT-116 세포를 이용하여 실험을 진행하였다. WRA를 HCT-116 세포에 여러 농도(31.3, 62.5, 125, 250, and 500 ㎍/㎖)로 24시간 동안 처리하여 세포생존율을 확인한 결과, 세포생존율이 유의적으로 감소하지 않았다(Fig. 2A).
하지만 EAR를 같은 조건으로 처리하였을 때 31.3 ㎍/㎖ 농도부터 세포생존율이 농도 의존적으로 감소하면서 500 ㎍/㎖ 농도에선 HCT-116 세포의 생존율이 71.22 ± 3.13%까지 감소하였다(Fig. 2B).
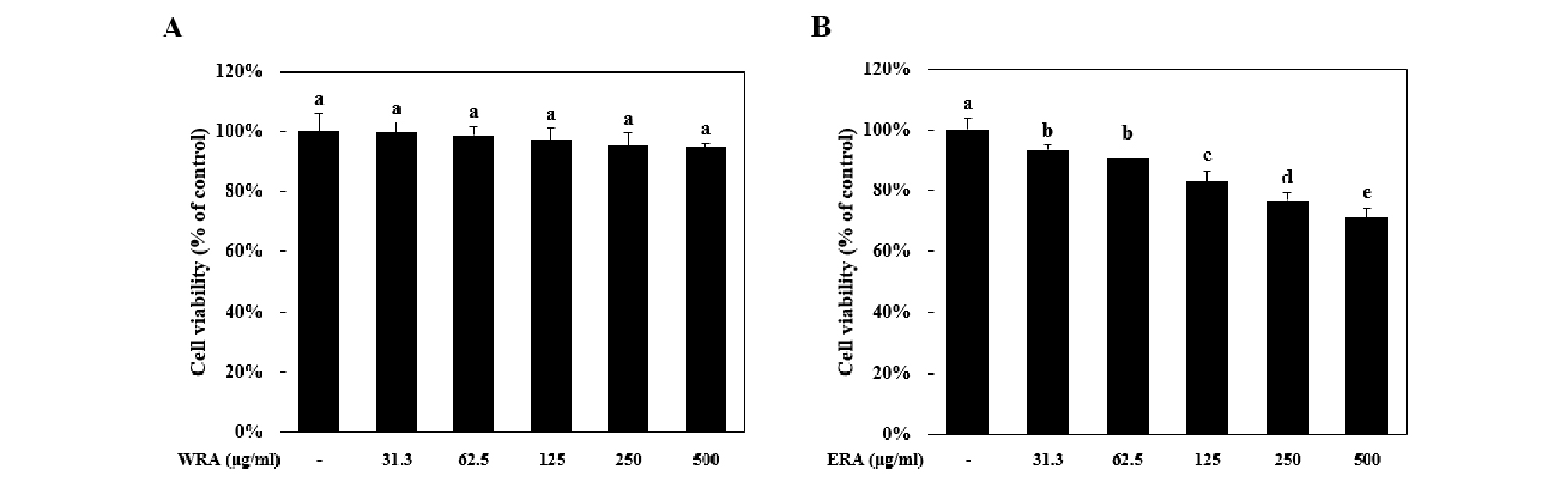
Fig. 2.
ERA (ethanol extract of Rubia akane Kakai) induced cell death in HCT-116 cells. (A-B) WRA; water extract of Rubiae radix, ERA; ethanol extract of Rubiae radix. HCT-116 cells were treated with various concentration (31.3, 62.5, 125, 250, and 500 ㎍/㎖) for 24 h. Cell viability was measured by MTS assay. Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p < 0.05 by Duncan’s multiple range test.
이와 같은 조건에서 Kim (2015)의 보고에 의하면, 개똥쑥 (Artemisia annua Linne) 에탄올 추출물은 100 ㎍/㎖ 농도에서 대장암 세포주인 HCT-116 세포에 대해 뛰어난 사멸효과를 나타낸다고 보고하였다.
개똥쑥은 항암효과가 매우 뛰어난 것으로 알려져 있으며(Singh, 2004), 이에 비교하였을 때 천초근 에탄올 추출물의 대장암세포 사멸효과는 개똥쑥 에탄올 추출물 보다 낮은 것으로 보아 천초근 에탄올 추출물에 존재하는 유효성분을 탐색하는 추가적인 실험이 필요할 것으로 생각된다.
천초근 에탄올 추출물의 HCT-116 세포주에 대한 caspase-3 활성화, DNA 단편화 유도활성
천초근 에탄올 추출물이 HCT-116 세포주에 대해 세포자멸사(apoptosis) 또는 세포괴사(necrosis)를 일으키는지 알아보기 위해, HCT-116 세포주에 ERA를 여러 농도(125, 250, and 500 ㎍/㎖)로 24시간 동안 처리하고, Annexin Vand propidium iodide (PI) 염색을 통해 유세포분석기를 이용하여 세포사의 비율을 확인하였다.
그 결과 500 ㎍/㎖ ERA를 24시간 동안 처리하였을 때 apoptotic cell death (apoptosis, Q2-4 + cell death, Q2-2)를 25.32%까지 증가시키는 것으로 확인했다(Fig. 3A).
다음으로 세포사에 관여하는 단백질인 caspase-3의 활성도를 확인한 결과, ERA를 500 ㎍/㎖ 농도로 처리하였을 때 정상대조군에 비교하여 135.44 ± 3.65% 까지 증가하였다(Fig. 3B).
앞선 결과와 마찬가지로, DNA fragmentaion을 확인하기 위해 Tunel 염색을 수행한 결과 ERA를 500 ㎍/㎖ 농도로 처리하였을 때 Tunel positive signal이 가장 많이 나타났다(Fig. 3C).
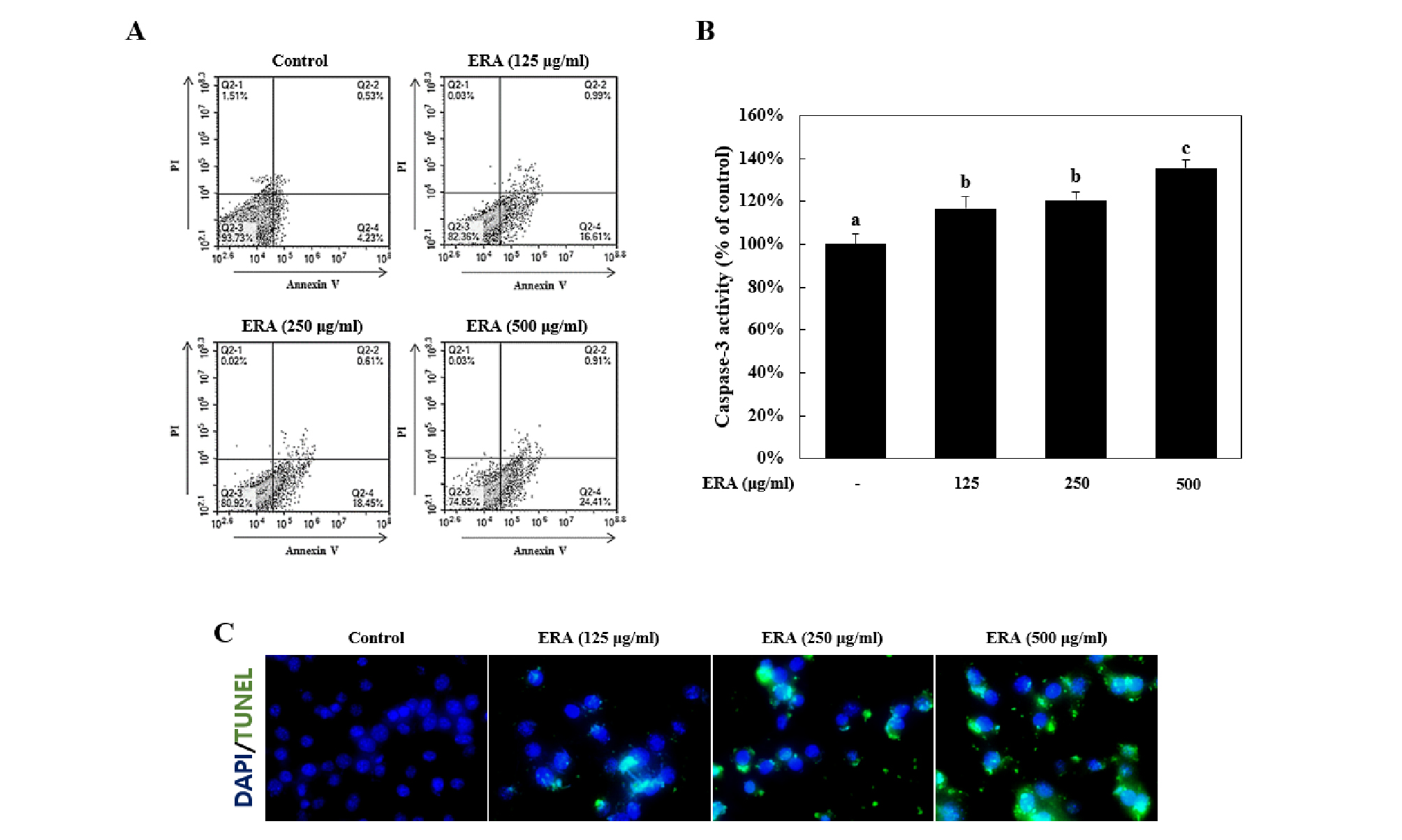
Fig. 3.
ERA induced caspase-3 activation and DNA fragmentation during apoptotic cell death in HCT-116 cells. ERA; ethanol extract of Rubiae radix. HCT-116 cells were treated with various concentration (125, 250, and 500 ㎍/㎖) for 24 h. (A) Annexin V and propidium iodide staining were analyzed by flow cytometry. (B) Caspase-3 activity was measured by capsase-3 activity assay. and (C) HCT-116 cells visualized by tunel assay. Representative images were taken from at least three independent experiments. Means values ± SD from triplicate separated experiments are shown. *Means with difference letters are significantly different at p < 0.05 by Duncan’s multiple range test.
결과를 종합하면, ERA는 대장암세포주인 HCT-116 세포에 500 ㎍/㎖ 농도로 처리될 때 apoptotic cell death와 DNA 단편화 및 caspase-3 활성화를 나타낸다. DNA 단편화(DNA fragmentation)는 apoptosis의 여러 특징 중 하나로 알려져 있으며, 이 과정에는 caspase-3, cytochrome c, and Apaf-1 같은 단백질들이 관여한다고 밝혀져 있다(Kitazumi and Tsukahara, 2010; Zhang and Xu, 2000).
밝혀진 바와 같이 ERA를 처리하였을 때 500 ㎍/㎖ 농도에서 apoptosis 뿐만 아니라 caspase-3 활성화와 DNA단편화가 유도되는 것으로 확인되었으며, 이는 ERA가 HCT-116 세포주에서 apoptosis를 통해 항암효과를 나타내는 것으로 생각된다.
하지만 이는 다른 연구논문들과 비교하였을 때 농도 대비 효과가 미미한 것으로 생각되며, 천초근 에탄올 추출물에 대장암 세포의 성장을 억제하는 유효성분을 찾을 뿐만 아니라 HCT-116 세포를 제외한 다른 대장암 세포주를 이용해 그 효능을 탐색하는 추가적인 실험이 필요할 것이라고 사료된다.
적요
본 연구는 꼭두서니의 뿌리인 천초근의 물 추출물과 에탄올 추출물을 이용하여 대장암 세포에 대한 암세포 성장 억제 및 사멸효과가 있는지 알아보고자 수행하였다. ERA(천초근 에탄올 추출물)은 폴리페놀(45.77 ± 2.03 ㎎/g)과 플라보노이드(22.82 ± 1.33 ㎎/g)를 함유하고 있었으며, H2O2에 의해 증가된 ROS (reactive oxygen species)를 억제하는 효과를 나타냈지만 WRA (천초근 물 추출물)은 효과가 없었다. 또한 ERA는 500 ㎍/㎖의 농도로 대장암 세포주(HCT-116)에 처리했을 때 세포사멸을 유도할 뿐만 아니라 caspase-3 단백질 활성화, DNA fragmentation 및 apoptotic cell death를 일으키는 것으로 확인되었다. 이는 ERA가 HCT-116 세포주에 대해 apoptosis(세포자멸사)를 통해 항암효과를 나타내는 것으로 생각되지만 다른 연구결과들과 비교하였을 때 농도 대비 효능이 미미하다. 따라서 천초근 에탄올 추출물에 대장암 세포의 성장을 억제하는 유효성분을 분석하여 그 효능을 탐색하는 추가실험이 필요할 것으로 생각된다.





