서 언
북방계 식물인 제비붓꽃(Iris laevigata Fisch.)은 붓꽃과(Iridaceae)의 붓꽃속(Iris L.)에 속하며, 북반구 온대에 분포하고 있다. 붓꽃속은 전세계적으로 약 150여종이 분포한다(Sim and Kim, 2002). 한반도에 자생하는 Iris 속은 특산식물인 노랑붓꽃(I. koreana Nakai), 노랑무늬붓꽃(I. odaesanensis Y.N.Lee), 넓은잎각시붓꽃(I. rossii Baker var. latifolia J.K.Sim & Y.S.Kim)을 포함해 총 17종이 분포하는 것으로 알려져 있다(Ministry of Environment, 2024). 제비붓꽃은 우리나라의 지리산과 강원도 고성을 비롯해 일본, 중국, 러시아에 분포한다. 제비붓꽃은 여러해살이풀로 짙은 자주색 꽃이 5~6월에 개화하는데, 꽃이 크고 아름다워 원예식물로서 가치가 높다. 제비붓꽃은 습지에서 생육하는데 현재 지리산의 개체군은 관찰되지 않고, 고성의 개체군 또한 습지 개발로 인한 자생지 파괴 위협에 처해있다(NIBR, 2012). 제비붓꽃의 자생지 수가 적고 개체수 또한 적기 때문에 멸종위기 야생생물 II급, IUCN 적색목록 위기종(EN)으로 보호받고 있다(KNA, 2022).
우리나라에서의 북방계 식물이란 식물 분포의 남방한계선이 한반도 내에 위치한 식물종을 말한다(Gantsetseg et al., 2020). 북방계 식물은 4차 빙하기에 북쪽에서 한반도로 유입된 뒤, 간빙기와 홀로세를 거치면서 온난해진 기후를 따라 고위도나 고지대로 이동한 빙하기의 유존종이다(Kong, 2005). 북방계 식물은 지구온난화와 같은 환경 변화에 매우 취약하고 고립된 지역이나 분포 한계선에 적은 수로 분포하기 때문에 현지외(ex-situ) 보전을 위한 기초연구가 필요한 실정이다(Gantsetseg et al., 2020; Kong, 2005). 그러나 북방계 식물 제비붓꽃의 생장에 관한 연구는 현재까지 수행된 바가 없고, 근연종인 대청부채(I. dichotoma Pall.)와 부채붓꽃(I. setosa Pall. ex Link)의 경우 발아와 유묘 생육에 효과적인 차광조건이 구명되었을 뿐이다(Lee et al., 2015).
현지외 보전이란 멸종위기종이 자생지 훼손 및 파편화로 인해 절멸 위기에 처할 때 이를 방지하기 위한 주요 방법이다(Crane, 2020; Smith and Pence, 2017; Whitlock et al., 2016). 멸종위기종의 효과적인 현지외 보전을 위해서는 먼저 대상종의 최적 생육 환경에 대한 지식이 요구된다. 빛은 식물 생육에 필수적인 에너지 공급원일 뿐만 아니라 광조건에 따라 서로 다른 광형태형성(photomorphogenesis) 반응이 일어나는 등 생활상에도 큰 영향을 미친다(Kim et al., 2013). 따라서 본 연구에서는 북방계 식물 제비붓꽃을 대상으로 차광처리에 따른 생장과 생리적 반응을 조사하였고, 이를 통해 생육 적정 광조건을 제시하여 현지외 보전에 필요한 대량번식과 재배기술에 필요한 정보를 제공하고자 하였다.
재료 및 방법
공시 재료 및 생육 환경
본 연구의 대상은 북방계 식물인 제비붓꽃(Iris laevigata Fisch.)이고, 실험 개체는 2023년 5월 국립DMZ자생식물원의 온실에서 발아시켰다. 발아한 개체를 한 달간 생육시킨 후 마사토와 원예상토를 1:2 비율로 충진한 지름 150 ㎜ 화분으로 이식시켰다. 7월 초 이식한 제비붓꽃 화분들을 차광 처리구 안에 배치하였다. 차광 처리구는 비닐하우스 제작용 파이프를 이용해 W2,000 × D14,000 × H2,000 크기로 4개 제작하였고, 차광 처리를 위해 시판하는 검은색 차광막(각 50%, 75%, 95%)을 씌워 차광 처리하였다. 나머지 1개는 햇빛을 온전히 수광하도록 하여 대조구로 삼았다. 광조건의 차이를 조사하기 위하여 휴대용 광파장 측정기(Li-180, Li-Cor Inc., USA)를 통해 광도와 광질을 측정하였다. 시험 포지로 이동한 개체는 저면관수를 통해 수분스트레스를 받지 않도록 관리하여 2023년 7월부터 9월까지 3개월 동안 서로 다른 광조건에서 생육시켰다. 처리구별 생장 수준이 유사한 개체 6본을 선정하여 실험에 공시하였고 광조건에 따른 생장 및 생리적 특성의 차이를 조사하였다.
생장 특성 조사
차광처리에 따른 제비붓꽃의 생장 특성을 알아보기 위하여 엽면적당 건중량(leaf mass per area; LMA)을 조사하였다. 처리구별 6개체에서 각각 1장의 잎을 채취하여 엽면적측정기(LI-3100C, Li-Cor Inc., USA)로 이용하여 엽면적을 측정하였다. 제비붓꽃의 잎은 검상(劍狀)의 넓은 선형이며, 잎의 끝부터 15 ㎝ 아래를 기준으로 약 10 ㎝ 부위를 채취하였다. 이후 송풍식 건조기에서 80℃로 48시간 동안 건조한 다음 건물중을 측정하여 LMA를 산출하였다.
엽록소 함량 조사
차광처리에 따른 제비붓꽃의 엽록소 함량 차이를 조사하기 위하여 처리구별 3장의 잎을 채취하였다. 채취한 잎의 부위는 생장 특성 조사와 동일하였다. 채취한 잎에서 펀칭기를 이용해 072 ㎠의 엽편을 획득한 다음 5 ㎖의 DMSO (dimethyl sulfoxide) 용액에 넣은 후, 항온기를 이용해 65℃에서 6시간 동안 색소를 추출하였다(Hiscox and Israelstam, 1979). 추출한 용액은 분광광도계(UV/VIS Spectro photometer-2550, Shimadzu Inc., Japan)를 이용하여 665.1 ㎚, 649.1 ㎚ 및 480.0 ㎚의 파장에서 흡광도를 측정하였고, Wellburn (1994)의 방법을 따라 엽록소 함량을 산출하였다.
엽록소 형광 반응 조사
차광처리에 따른 제비붓꽃의 최적양자효율(Fv/Fm)과 비광화학적 형광소멸(non-photochemical quenching; NPQ) 차이를 조사하기 위하여 엽록소 형광반응 측정기(PAM-2100, Heinz Walz GmbH, Germany)를 이용하였다. 측정 대상 잎의 광합성계 열방출경로를 불활성시키기 위하여 암적응용 sample clip으로 20분간 측정 부위의 광을 차단하였다. 형광 강도 측정은 quenching analysis 방법을 이용하였다. 엽록소 형광 반응을 측정할 때 Fo는 0.1 μmol m-2 s-1 이하, Fm은 0.8초 동안 8,000 μmol m-2 s-1의 포화광을 조사하였다. 광화학 반응에 대한 값은 Lichtenthaler et al. (2005)의 방법을 따라 산출하였다.
광합성 특성 조사
차광처리가 제비붓꽃의 광합성 능력에 미치는 영향을 조사하기 위하여 대조구와 각 처리구에서 엽령이 유사한 잎 6개를 선정하였다. 수분스트레스에 의한 오차를 방지하기 위하여 측정 전일에 충분히 관수하였고, 광에 의한 오차 방지를 위하여 암적응시켰다. 광합성 특성 조사는 광합성 측정기(LI-6400XT, Li-Cor Inc., USA)를 이용하였고 Kim and Lee (2001)의 방법에 준하여 수행하였다. 잎에 조사되는 빛의 강도를 조절하여 광반응곡선(light-response curve)를 작성하였다. 그리고 잎에 공급되는 이산화탄소(CO2) 농도를 조절하여 CO2-광합성곡선(A-Ci curve)을 작성하였다. 광-광합성곡선과 CO2-광합성곡선의 해석은 Kim and Lee (2001)의 방법을 토대로 하였다. 증산속도(transpiration rate)와 기공전도도(stomatal conductance)는 Caemmerer and Farquhar (1981)의 방법을 따라 산출하였다. 수분이용효율(water use efficiency) 조사는 Kim et al. (2002)의 방법에 따라 광합성속도와 동시에 측정된 증산속도의 값을 이용하여 산출하였다.
통계 처리
본 실험의 결과값에 대한 통계적 유의성을 검정하기 위하여 SPSS version 21.0 (IBM Inc., USA)를 통해 일원배치분산분석(One-way ANOVA)을 실시하였다. 분산의 균질성은 Levene’s test으로 평가하였고, 각 처리 간의 유의성은 Scheffe’s significant difference test와 Dunnnett’s T3 test (p = 0.05)로 사후검정하였다. 처리별 특성 값들에 대해 Pearson 상관분석을 실시하였으며 집단의 정규성 검정은 Shapiro-wilk test를 통해 평가하였다.
결 과
대조구의 전천광을 기준으로 하여 차광처리별 상대광도(relative light intensity)를 측정하였다(Table 1). 50%와 75% 차광처리구의 상대광도는 50.9%와 26.2%로 나타났고 95%의 차광처리구는 12.0%로 나타나 차광수준이 시판 규격에 미달한 것으로 나타났다. 차광처리별 광질(light quality)은 모든 차광처리구가 대조구와 큰 차이가 없었다. 차광처리가 제비붓꽃의 생장에 미치는 영향을 검토하기 위하여 차광처리구별 엽면적당 건중량을 Table 1에 나타내었다. 제비붓꽃의 엽면적당 건중량은 전천광을 수광하는 대조구에서 가장 높았고, 50% > 75% > 95% 차광처리 순으로 값이 유의미하게 저하하였다.
Table 1.
Relative light intensity (RLI), light quality, and resulting leaf mass per area (LMA) of Iris laevigata in sunlight and each shaded treatment plot. R/FR is the ratio of infrared to far infrared.
| Light condition | Sunlight | Shaded 50% | Shaded 75% | Shaded 95% | py |
| PARz (μmol m-2 s-1) | 1,866.33 | 950.71 | 327.62 | 116.33 | |
| RLI (%) | 100.00 | 50.94 | 26.23 | 12.01 | |
| R/FR | 1.06 | 1.06 | 1.04 | 1.04 | n.s. |
| LMA (㎎/㎠) | 8.26±0.98a | 6.69±1.18ab | 5.61±0.36bc | 4.15±0.37c | * |
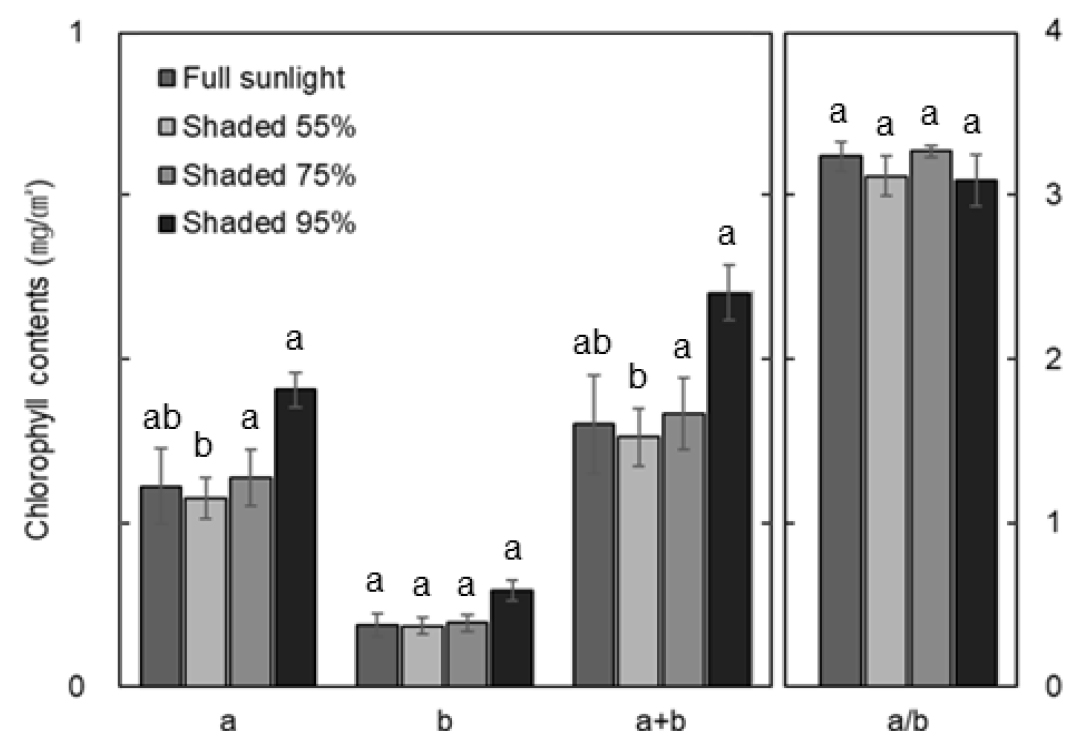
차광처리에 따른 제비붓꽃의 엽록소 함량 a, b, a+b와 a/b를 Fig. 1에 나타내었다. 엽록소 a 함량(㎎/㎠)은 대조구에서 0.31±0.06이었고 50% 차광에서는 0.29±0.03으로 나타나 대조구에 비해 낮았다. 75%와 95% 차광에서는 0.32±0.04, 0.45±0.03으로 나타났는데 이는 대조구와 50% 차광보다 유의미하게 높은 수치였다. 엽록소 b 함량은 대조구부터 50% > 75% > 95% 순으로 각각 0.09±0.02, 0.09±0.01, 0.10±0.01 그리고 0.15±0.02로 나타났고 처리구 간에 유의미한 차이는 없었다. 엽록소 a+b 함량은 대조구부터 50% > 75% > 95% 순으로 각각 0.40±0.08, 0.38±0.04, 0.42±0.05 그리고 0.60±0.04로 나타났다. 엽록소 a+b 함량은 a 함량과 유사한 경향으로 나타나 50% 차광은 대조구보다 낮고 75%와 95% 차광은 대조구에 비해 유의미한 수준으로 높았다. 엽록소 a/b는 대조구부터 50% > 75% > 95% 순으로 각각 3.24±0.09, 3.12±0.12, 3.27±0.03 그리고 3.09±0.16 순으로 나타났으나 처리구 간에 유의미한 차이는 없었다.
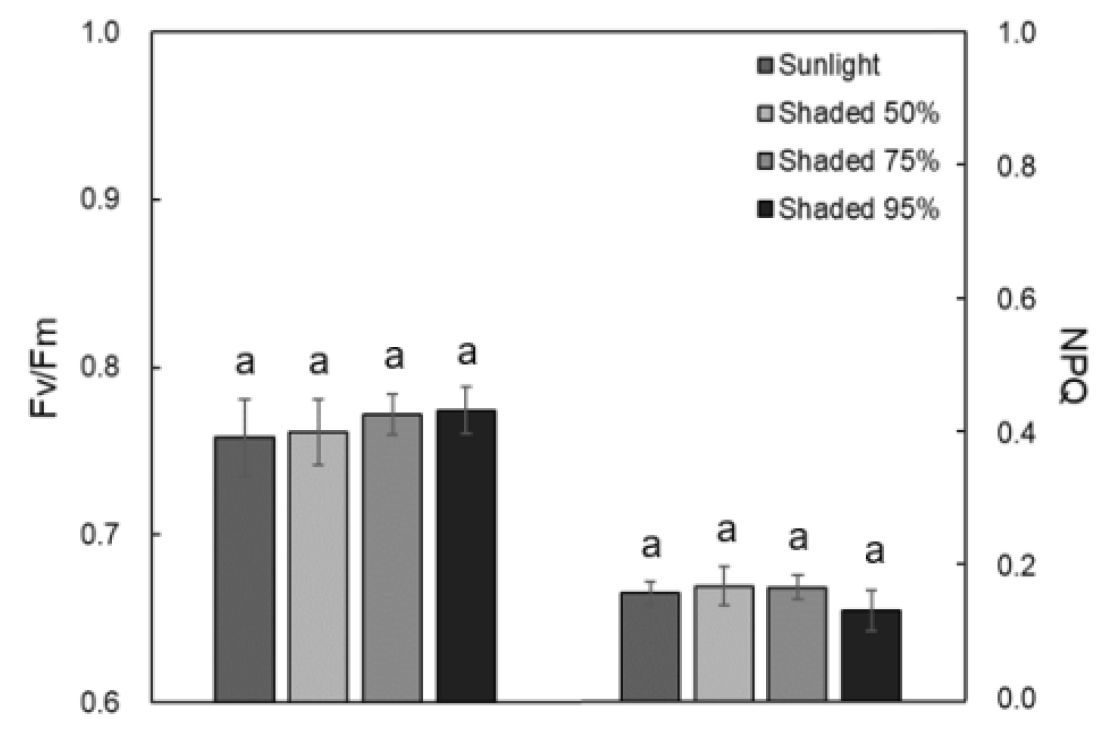
차광처리에 따른 제비붓꽃의 Fv/Fm과 NPQ를 Fig. 2에 나타내었다. Fv/Fm은 대조구와 50% 차광에서 0.76±0.02로 동일한 수치를 나타냈고, 75%와 95% 차광에서도 0.77±0.01로 값이 동일하였다. 그러나 Fv/Fm는 차광처리구 간에 유의미한 차이가 없었다. NPQ는 대조구에서 0.16±0.02, 50%에서 0.17±0.03, 75%에서 0.17±0.02 그리고 95%에서 0.14±0.03으로 나타났으나 이 또한 차광처리구 간에 유의미한 차이가 없었다.
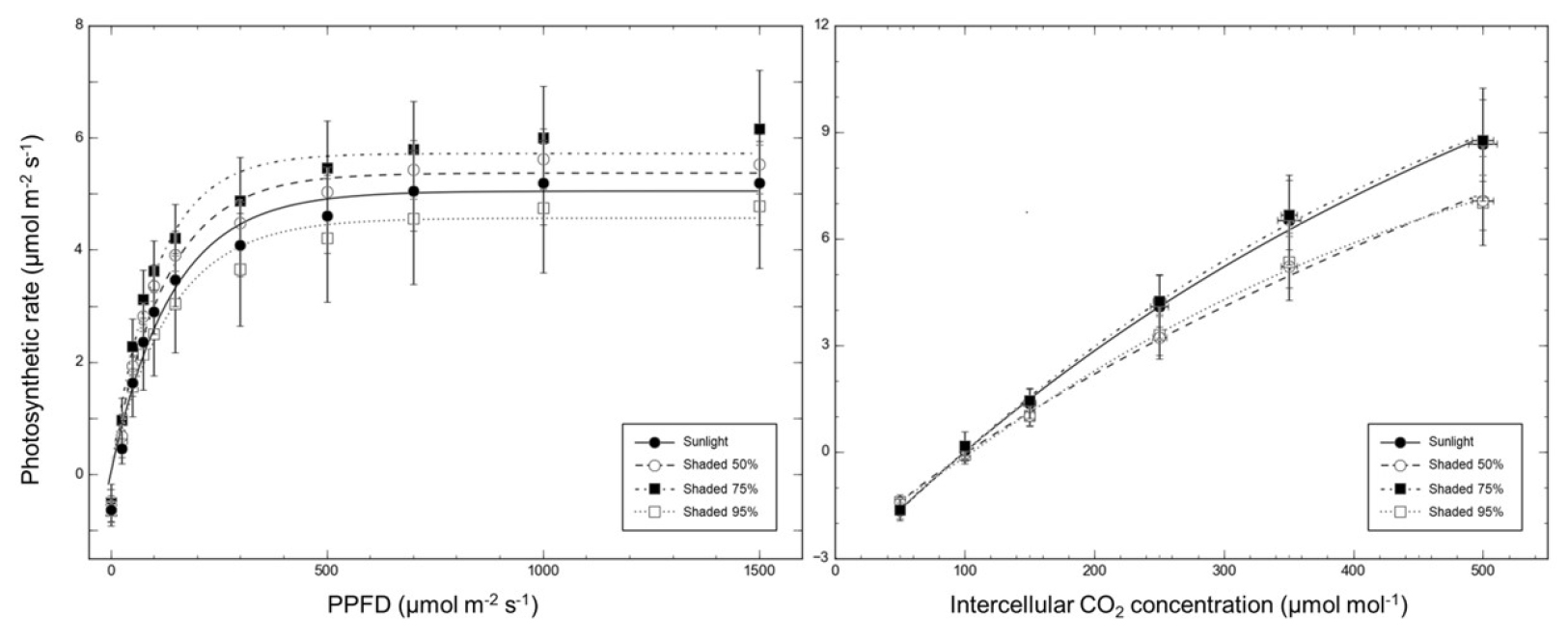
광도 변화에 따른 제비붓꽃의 광합성 특성을 분석하기 위하여 광반응곡선(light-response curve)을 작성하고(Fig. 3a), 이를 이용하여 암호흡속도(dark respiration; Rd), 광보상점(light compensation point; LCP), 광포화점(light saturation point; LSP), 최대 광합성속도(maximum photosyntheticsis rate; PNmax), 순양자수율(apparent quantum yield; AQY)을 산출하였다(Table 2). 제비붓꽃의 암호흡속도는 차광처리에 따른 유의미한 차이가 없었고, 차광처리별 광보상점과 광포화점 또한 유의미한 차이가 없었다. 광합성속도는 75% 차광처리에서 가장 높게 나타났고 95% 차광처리에서 가장 낮게 나타났다. 대조구와 50% 차광처리에서의 광합성속도는 75% 차광처리에 비해 낮았으나 두 처리 간에 차이는 없었다. 순양자수율은 95% 차광처리에서 가장 높게 나타났고 다음으로 대조구가 높았다. 50%와 75% 차광처리에서의 순양자수율은 대조구보다 낮았으나 두 처리 간에 차이는 없었다.
Table 2.
Photosynthetic characteristics of Iris laevigata in response to shading treatments estimated from photosynthesis curves. I laevigata grown in 75% shading had the highest PNmax, even though the maximum PAR during the day was below the LSP.
|
Photosynthetic characteristicsz | Shade Level (%) | |||
| 0 | 50 | 75 | 95 | |
| Rd | 0.45±0.13a | 0.35±0.17a | 0.35±0.09a | 0.36±0.24a |
| LCP | 10.00±2.83a | 6.00±4.24a | 6.00±3.12a | 10.00±8.25a |
| LSP | 555.67±38.38a | 558.33±18.12a | 579.25±32.18a | 516.00±49.16a |
| PNmax | 5.22±0.76ab | 5.62±0.54ab | 6.20±0.89a | 4.81±1.10b |
| AQY | 28.62±2.98ab | 25.59±1.23b | 24.41±2.13b | 33.15±7.32a |
zDark respiration; Rd [μmol (CO2) m-2 s-1], light compensation point; LCP [μmol m-2 s-1], light saturation point; LSP [μmol m-2 s-1], maximum photosynthesis rate; PNmax [μmol (CO2) m-2 s-1], net apparent quantum yield; AQY [mmol (CO2) mol-1]. The assumption of homogeneity of variance was assessed with Levene’s test. Differences between groups were tested with Scheffe’s significant difference test or, when variances were unequal, with Dunnnett’s T3 test. Statistical significance was set at p < 0.05 and analyses were performed using SPSS (version 21). Values are means ± standard deviations (n=6).
제비붓꽃 잎에 공급되는 공기의 CO2 농도를 달리하여 측정한 광합성속도를 CO2-광합성곡선(A-Ci curve)으로 나타내고(Fig. 3b), 이를 토대로 광호흡속도(photo-respiration rate; Rp), CO2보상점(CO2 compensation point; CCP), CO2포화점(CO2 saturation point; CSP), 최대 광합성속도(maximum photosynthesis rate; PNmax), 탄소고정효율(carboxylation efficiency; CE)을 산출하였다(Table 3). 광반응곡선과 달리 CO2-광합성곡선을 통해 산출된 5가지 광합성 지표는 모든 처리 간에 유의미한 차이는 없었다.
Table 3.
Photosynthetic characteristics of Iris laevigata in response to shading treatments estimated from A-Ci curves.
|
Photosynthetic characteristicsz | Shade Level (%) | |||
| 0 | 50 | 75 | 95 | |
| Rp | 2.94±0.46a | 2.45±0.36a | 2.91±0.49a | 2.50±0.23a |
| CCP | 89.78±3.23a | 91.60±2.10a | 87.98±5.17a | 91.58±3.81a |
| CSP | 303.02±15.18a | 288.33±17.56a | 313.75±16.30a | 297.31±19.70a |
| PNmax | 8.66±1.59a | 7.90±0.37a | 8.77±1.15a | 7.02±0.78a |
| CE | 0.03±0.01a | 0.02±0.00a | 0.03±0.00a | 0.02±0.00a |
zPhoto-respiration rate; Rp [μmol (CO2) m-2 s-1], CO2 compensation point; CCP [μmol (CO2) m-2 s-1], CO2 saturation point; CSP [μmol (CO2) m-2 s-1], maximum photosynthesis rate; PNmax [μmol (CO2) m-2 s-1], carboxylation efficiency; CE [μmol (CO2) mol-1]. The assumption of homogeneity of variance was assessed with Levene’s test. Differences between groups were tested with Scheffe’s significant difference test or, when variances were unequal, with Dunnnett’s T3 test. Statistical significance was set at p < 0.05 and analyses were performed using SPSS (version 21). Values are means ± standard deviations (n=6).
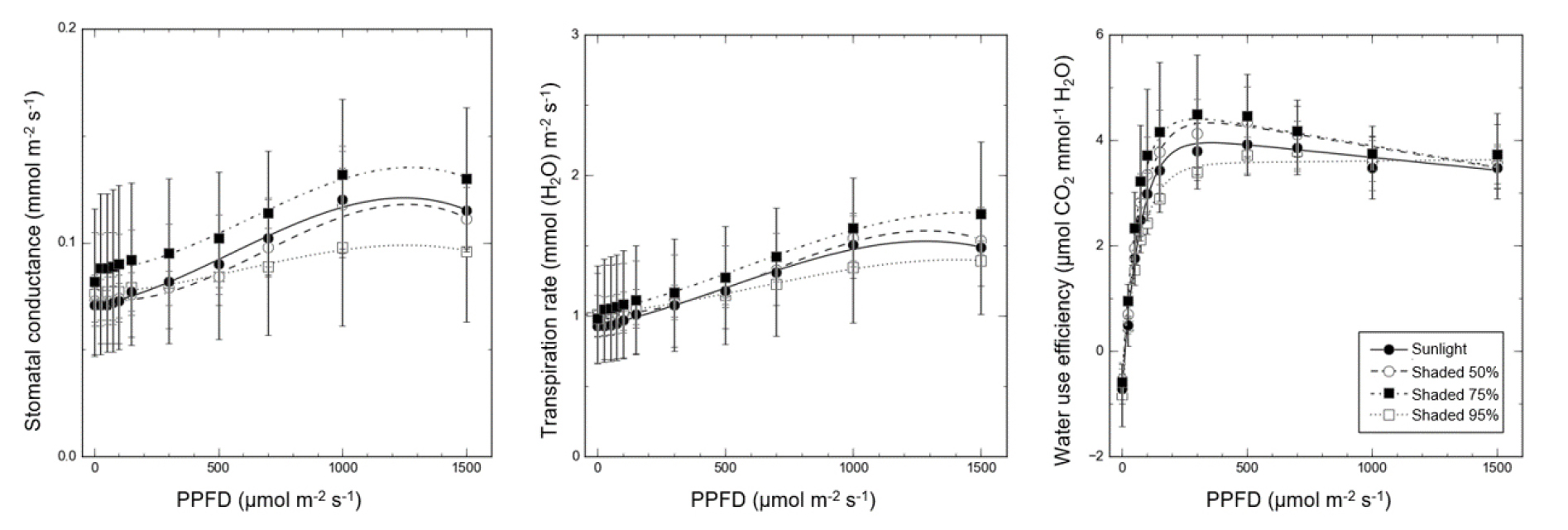
광도에 따른 제비붓꽃의 기공전도도, 증산속도 그리고 수분이용효율을 Fig. 4에 나타내었다. 기공전도도는 광도 변화에 따라 1,000 μmol m-2 s-1까지 증가하였다가 이후 감소하는 경향이 나타났다(Fig. 4a). 증산속도 또한 기공전도도와 유사한 경향이 나타났다(Fig. 4b). 수분이용효율을 살펴보면 모든 처리가 광도 0 μmol m-2 s-1에서 가장 낮은 수준을 보였으나 광합성속도가 양(+)으로 전환되는 광보상점 부근에서 효율이 0 이상으로 증가하였다(Fig. 4c). 수분이용효율은 광도가 상승함에 따라서 증가하다가 광포화점 부근부터는 점진적으로 감소하는 경향이 나타났다.
고 찰
차광처리별 광질을 측정한 결과에서 적색과 원적색광의 비율을 나타내는 R/FR 비율의 유의미한 차이가 없었다(Table 1). 식물은 광합성에 유효한 적색광 파장을 우선적으로 흡수·이용하기 때문에 R/FR 비율은 식물의 광형태형성 반응을 파악하는 지표로 이용된다(Skálová et al., 1999). 본 연구에서는 차광막에 의한 광질의 저하가 관찰되지 않았기 때문에 광도의 차이만이 제비붓꽃의 생장에 영향을 미쳤다고 판단한다. 엽면적당 건중량은 단위 잎 면적당 잎의 건중량을 뜻하고 잎의 두께와 엽육조직의 치밀도를 반영하기 때문에 식물의 생장과 탄소 흡수를 설명하기 위하여 사용되는 중요한 생장 지표이다(Cheng et al., 2014). 본 연구 결과에서 제비붓꽃의 엽면적당 건중량은 차광수준이 높아질수록 값이 유의미하게 감소하였는데, 낮은 광도에 적응하기 위하여 광합성을 위한 빛의 흡수율이 높은 잎이 형성되었기 때문으로 보인다(Kim and Lee, 2001; Park et al., 2021). 더 많은 양의 빛을 수광하기 위하여 잎의 신장생장이 촉진되었고 엽면적이 넓어지는 음엽화 현상이 나타난 것으로 판단한다(Kim et al., 2001).
차광처리에 따른 제비붓꽃의 엽록소 함량을 살펴보면 75%와 95% 차광에 의한 제비붓꽃의 엽록소 a와 a+b 함량이 대조구에 비해 높은 것을 확인할 수 있는데(Fig. 1), 차광수준이 높은 곳에서 생육한 식물일수록 엽록소 함량이 높아진다는 보고와 일치하였다(Kim and Lee, 2001). 이는 광합성에 필요한 광량이 부족하여 광수용능력을 극대화하고자 나타나는 현상이다(Lee et al., 2013). 약광조건에서는 엽록소 a보다 b의 증가가 더 크다고 알려져 있는데, 광합성 반응중심에 주로 결합되어 있는 엽록소 a보다 광수확단백질복합체(light harvesting complex)를 구성하는 엽록소 b의 역할이 크기 때문이다(Kim et al., 2008; Lee et al., 2019). 약광조건에 적응된 잎일수록 엽록소 a/b가 감소하여 음엽화의 지표로 사용된다(Lee et al., 2019). 제비붓꽃은 차광처리에 따른 엽록소 b의 유의미한 증가를 확인할 수 없었고, 이에 따라 엽록소 a/b 또한 처리 간에 유의미한 차이가 없던 것으로 보인다.
식물의 엽록소 분자가 광합성을 위해 적색광을 흡수하면 들뜬 상태(excited state)가 되고 에너지적으로 불안정한 상태를 해소하기 위하여 에너지 소멸 경로를 활성화한다(Maxwell and Johnson, 2000). 이 과정에서 발생하는 열과 형광 반응을 통해 식물이 받는 환경 스트레스를 진단할 수 있다(Rascher et al., 2000). Fv/Fm은 광계 II의 활성을 나타내는 지표로 들뜬 에너지 포획 능력을 나타내는데(Rosenqvist and van Kooten, 2003; Sung et al., 2010), 일반적으로 환경 스트레스에 대한 식물의 반응을 진단하기 위하여 사용된다(Lee et al., 2002). Fv/Fm은 식물이 받는 스트레스 수준이 증가할수록 감소하는 경향을 보인다고 알려져 있는데(Baker, 2008; Borkowska, 2002; Lawson et al., 2008), 제비붓꽃은 차광처리 간에 Fv/Fm의 차이가 없었다(Fig. 2). 제비붓꽃의 Fv/Fm은 모든 처리에서 0.8 이하를 나타냈는데, 건강한 식물의 잎은 0.74에서 0.85 수준의 Fv/Fm을 나타낸다는 선행 연구로 미루어 보아 제비붓꽃의 생육이 전체적으로 양호했던 것으로 보인다(Lichtenthaler et al., 2005; Strasser et al., 2000). NPQ는 식물이 한계 이상으로 받아들인 빛에너지를 소멸시키기 위하여 이용하는 보호 기작으로 설명된다(Genty et al., 1990). NPQ는 Fv/Fm과는 반대의 경향을 보이며 일반적으로 약광조건에서 높아지는데(Cho et al., 2021; Ruban, 2016), 일부 내음성이 높은 식물에서는 빛의 강도가 낮아질수록 NPQ가 감소한다는 보고도 있다(Cun et al., 2023; Martins et al., 2014). 그러나 제비붓꽃의 NPQ 또한 Fv/Fm과 마찬가지로 차광처리간 차이가 없었고(Fig. 2), 단기적 차광처리에 의한 제비붓꽃의 스트레스 반응을 진단하기에 엽록소 형광지수 Fv/Fm과 NPQ의 활용은 어려울 것으로 판단한다.
광반응곡선을 통해 광도 변화에 대한 제비붓꽃의 광합성 반응을 살펴보면 다음과 같다. 암호흡속도는 광합성에 필요한 에너지를 획득하는 과정이고 차광에 따라 감소하는 경향이 나타난다(Kim et al., 2008; Werf et al., 1988). 약광조건에서 광합성을 수행하기 위하여 암호흡속도와 광보상점의 감소가 나타날 수 있는데(Lee et al., 2013), 본 연구 결과에서는 차광처리에 따른 제비붓꽃의 암호흡속도와 광보상점의 차이를 확인할 수 없었다(Table 2). 음지식물의 광포화점은 100~200 μmol m-2 s-1 범위에 해당하는데(Larcher, 1995), 제비붓꽃의 광포화점은 차광처리에 의한 차이를 확인할 수 없었으나 모든 처리에서 500 μmol m-2 s-1 이상을 나타내 양지식물에 해당하는 것으로 판단한다. 차광처리구별 최대광도를 살펴보면 대조구와 50% 차광에서는 제비붓꽃의 광포화점 이상이었으나 75%와 95% 차광에서는 광포화점 이하로 나타났다(Table 1 and 2). 그렇지만 제비붓꽃의 광합성속도는 75%까지 차광수준이 높아질수록 증가하다가 차광수준이 95%가 되어서야 감소하였다. 앞서 제비붓꽃을 양지성인 것으로 판단했지만 적은 광량에도 광합성 능력을 유지하는 것으로 보이며, 상대광도 95% 수준에서는 광합성 효율이 현저히 저하되는 것으로 판단한다. 순양자수율은 빛에너지를 화학에너지로 변환시키는 광화학계 활성을 나타내며(Evans, 1987), 약광 조건에서 광합성 능력을 나타내는 지표로 이용된다(Kim and Lee, 2001). 또한 약광조건에 적응한 식물일수록 효율적인 광합성을 위하여 엽내 질소를 엽록소 생성에 투자함으로써 순양자수율이 높아진다(Kim and Lee, 2001). 본 연구 결과에서도 상대적으로 광량이 적은 95% 차광처리에서 다른 차광처리에 비해 높아진 순양자수율을 확인할 수 있어 제비붓꽃이 약광조건에 적응했음을 알 수 있다.
엽육 내 CO2 농도(Ci)에 대한 광합성반응(A) 곡선인 A-Ci curve는 광합성계의 암반응에 속하는 탄소고정계의 능력을 평가하는 방법이다(Farquhar and Sharky, 1982; Kim and Lee, 2001; Sung et al., 2023). A-Ci curve에서 대기의 CO2 농도부터 CO2포화점까지의 Ci의 값은 광계II와 광계I에서 일어나는 전자전달속도에 의한 광합성속도를 말한다(Kim and Lee, 2001). 일반적으로 CO2 농도가 전자전달속도에 미치는 영향을 검토하기 위하여 CO2 포화점에서의 광합성속도를 살펴보는데, 본 연구 결과에서 제비붓꽃의 CO2 포화점과 광합성속도는 처리 간에 유의미한 차이가 없었다(Table 3). 탄소고정효율은 rubisco 함량의 지표로 볼 수 있는데 약광조건에서 생육한 식물은 탄소고정효율이 낮아져 rubisco 활성에 영향을 미칠 수 있다(Kim et al., 2022). 그러나 탄소고정효율 또한 처리 간에 유의미한 차이를 확인할 수 없었고, 탄소고정효율과 길항적으로 작용하는 광호흡 또한 처리 간에 차이가 없었다. 광 부족에 따른 스트레스로 탄소고정계의 활성이 저하할 수 있으나(Kim et al., 2022), 제비붓꽃은 광화학계 활성만이 저하된 것으로 보이고 차광처리가 탄소고정계에 미치는 영향은 적은 것으로 판단한다.
광합성속도의 증가는 기공을 통해 CO2를 흡수하는 것뿐만 아니라 기공전도도를 높여 엽록소의 CO2 흡수량을 증가시키기 때문에 광합성속도와 기공전도도는 양(+)의 상관을 갖는다(Ghasemzadeh et al., 2010). 차광처리에 따른 제비붓꽃의 광합성속도를 비교해보면 75% > 50% = 00% > 95% 순의 차이가 나타나고(Table 2), 기공전도도와 증산속도 또한 이와 유사한 차이를 보였다(Fig. 4a and 4b). 증산속도도 기공전도도와 마찬가지로 광합성속도와 양(+)의 상관을 가지므로 광합성속도가 증가할수록 증산속도가 증가한다(Kim et al., 2021). 수분이용효율은 광포화점 부근부터 점진적으로 감소하였는데, 이는 수분이용효율이 광합성 동화산물에 대한 증산속도로 계산되므로(Kim et al., 2002), 잎으로 조사되는 광도가 증가하면서 광합성속도의 증가는 둔화하였지만 증산속도는 지속적으로 상승했기 때문으로 보인다. 높은 광도에서 생육한 잎은 많은 빛에너지로 인해 온도가 높아질 수 있으므로 증산작용이 활발하게 일어난다. 이를 위해 기공의 수 또한 낮은 광도에서 생육한 잎보다 많아지며, 대조구에서 제비붓꽃의 기공전도도와 증산속도가 95% 차광처리에 비해 높은 것은 이러한 사실을 뒷받침한다. 50%와 75% 차광처리 또한 대조구와 비슷한 수준의 기공전도도와 증산속도를 나타냈고, 이러한 사실로 미루어 보아 제비붓꽃은 양지성 식물이지만 75% 차광수준까지 적응할 수 있을 것으로 판단한다.
차광처리가 제비붓꽃에 미치는 영향을 검토하기 위하여 차광처리에 따른 상대광도와 생장 및 생리적 특성 변수 간 Pearson 상관분석을 실시하였다(Fig. 5). 먼저 상대광도를 살펴보면 상대광도는 제비붓꽃의 엽면적당 건중량과 양의 상관을 나타내고(p < 0.001), 엽록소 함량과는 음의 상관을 나타내었다(p< 0.01). 엽면적당 건중량과 엽록소 함량은 음의 상관을 나타내었다(p< 0.01). 엽록소 함량은 순양자수율과 양의 상관에 있고(p< 0.01), 순양자수율은 최대 광합성속도와 음의 상관을 보인다(p< 0.001). 한편 순양자수율은 광보상점과 양의 상관을 나타냈는데(p< 0.01), 광보상점은 최대 광합성속도와 음의 상관을 보인다(p< 0.001). 최대 광합성속도는 암호흡속도와 음의 상관을 보이고(p< 0.05), 압호흡속도는 광보상점에 영향을 미쳐 서로 양의 상관을 나타내었다(p< 0.001). 제비붓꽃 탄소고정계의 상관을 살펴보면 탄소고정효율과 최대 광합성속도가 양의 상관을 보이고(p< 0.001), CO2포화점은 광호흡속도 그리고 탄소고정효율과 양의 상관을 나타내었다(p< 0.001). 또한 광호흡속도가 높아질수록 최대 광합성속도와 탄소고정효율이 감소하는 음의 상관임을 알 수 있다(p< 0.001). 이러한 Pearson 상관분석 결과는 차광처리에 의한 제비붓꽃의 생장 및 생리적 특성 결과를 뒷받침한다.
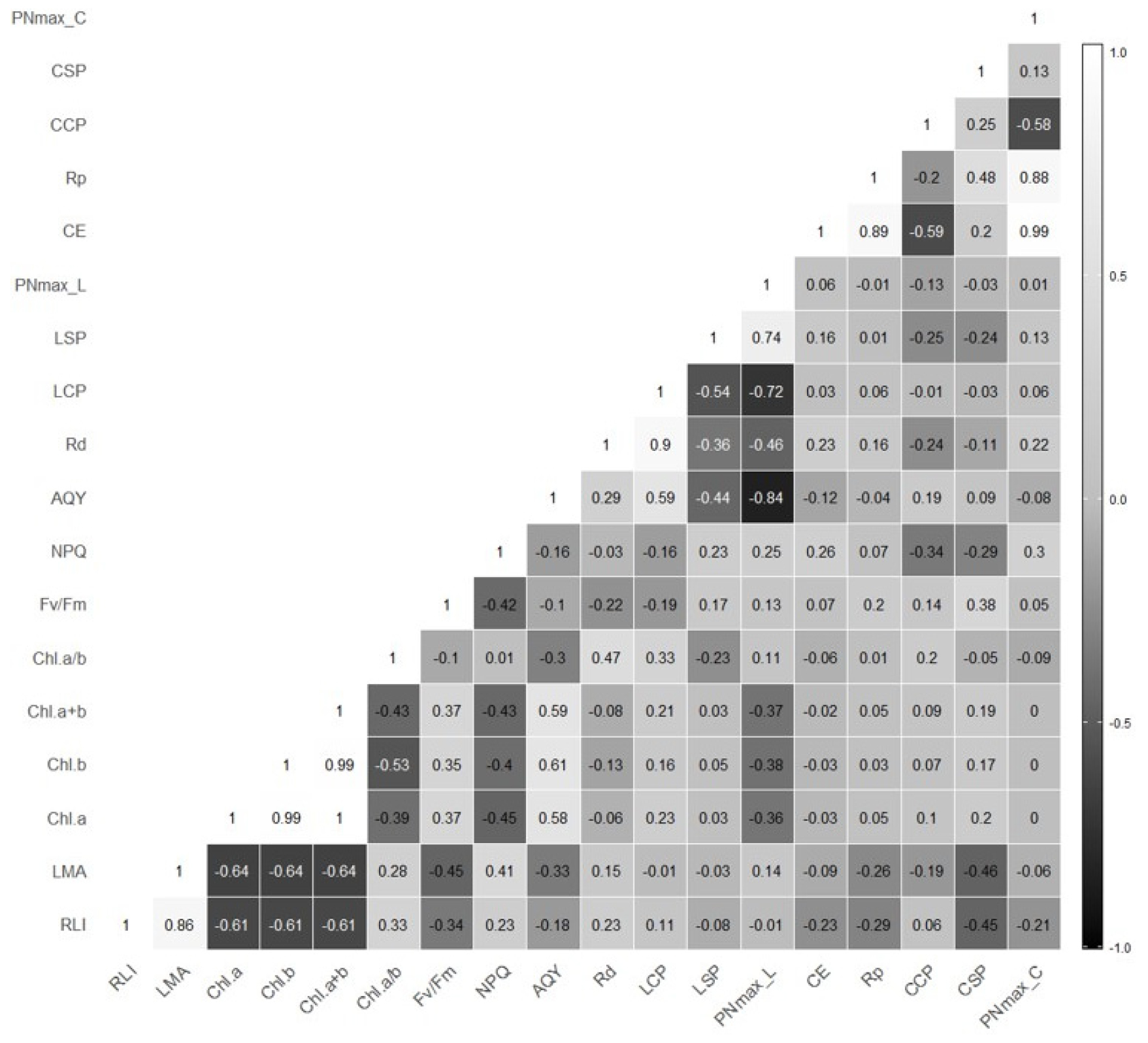
Fig. 5.
Heatmap of Pearson correlation analysis of growth and physiological characteristics of Iris laevigata in response to shading treatments. Closer to white indicates a positive correlation and closer to black indicates a negative correlation. (RLI; relative light intensity, LMA; leaf mass per area, Chl; chlorophyll contents; Fv/Fm; maximum quantum efficiency of PSII photochemistry, NPQ; nonphotochemical chlorophyll fluorescence quenching, Rd; dark respiration, LCP; light compensation point, LSP; light saturation point, PNmax_L; maximum photosynthesis rate in photosynthesis curves, AQY; net apparent quantum yield, Rp; photo-respiration rate, CCP; CO2 compensation point, CSP; CO2 saturation point, PNmax_C; maximum photosynthesis rate in A-Ci curves, CE; carboxylation efficiency).
적 요
본 연구에서는 북방계 식물 제비붓꽃의 현지외 보전에 필요한 생육 적정 광조건을 제시하기 위하여 차광처리에 따른 제비붓꽃의 생장과 생리적 반응을 조사하였다. 전천광을 수광하는 대조구와 서로 다른 차광처리구(50%, 75%, 95%)를 설치하고 엽면적당 건중량, 엽록소 함량과 형광 반응, 광합성 특성을 조사하였다. 제비붓꽃은 차광수준이 강해질수록 낮은 광도에 적응하기 위하여 광합성 효율이 높아진 잎이 형성되었다. 차광수준이 높아질수록 엽록소 함량이 증가하였고, 엽면적이 증가하면서 엽면적당 건중량은 감소하였다. 차광처리에 의해 엽록소 형광 반응 Fv/Fm과 NPQ는 변화하지 않았고, 탄소고정계의 활성 또한 처리 간에 차이가 없었다. 제비붓꽃은 양지식물에 해당하는 광포화점을 나타냈고, 75% 차광수준까지 광합성 능력을 대조구와 비슷한 수준으로 유지하였다. 제비붓꽃의 순양자수율은 95% 차광처리에서 현저히 감소하여 낮은 광조건에 적응한 상태를 보였다. 제비붓꽃은 전천광 대비 95% 차광수준에서 생육할 시 광합성 능력이 저하하는 것으로 보이며, 차광 상태를 지속하여 광을 제한할수록 생육이 불리할 것으로 판단된다.