서언
재료 및 방법
병 발생상황 조사
병원균 분리 및 동정
병원균 DNA 추출
PCR 및 염기서열 분석
결과 및 고찰
2017년 인삼 6 년근 수확포장의 인삼 뿌리썩음병 발생현황
인삼 뿌리썩음병 관련 병원균 분리 및 동정
유연관계 분석을 통한 인삼뿌리썩음병균의 종 동정
적요
서언
인삼(Panax ginseng C. A. Meyer)은 동일포장에서 4∼6년간 재배로 인해 각종 병해에 의한 피해가 크게 나타난다. 특히 가장 큰 피해를 미치는 것은 인삼 뿌리썩음병으로 이들과 관련된 병원체는 곰팡이, 선충, 세균 등이 있는데 그 중 Ilyonectria radicicola (불완전세대명 : Cylindrocarpon destructans)와 Nectria haematococca (불완전세대명 : Fusarium solani)는 인삼 뿌리썩음병의 주요 원인균으로 재배 이후에도 후벽포자 등이 10년 이상 토양에 존재하며, 인삼의 연작장해 원인으로도 보고되었다(Cho et al., 1995; Lee, 2004; Kang et al., 2007). 이들 인삼 뿌리썩음병을 방제하기 위하여 경종적, 화학적 및 생물학적 방제에 관한 연구들뿐만 아니라 인삼 재배 시 파인버블(fine bubble)을 이용하여 인삼 뿌리를 발달시켜 뿌리썩음병을 억제시키는 연구들이 수행되고 있다(Yu et al., 1990; Kim et al., 1993; Ahn, 2017; Lee et al., 2018).
대표적인 인삼뿌리썩음병균인 C. destructans는 삼나무, 감자, 당근뿐만 아니라 식물과 수목의 근권에서도 부생적으로 존재하는 균으로 알려져 있다(Singleton et al., 1992; Punja, 1997; Reeleder et al., 2002). 최근 C. destructans는 multi-locus 분석과 이들의 균학적 특성을 통해 새롭게 I. radicicola 그룹(I. radicicola species complex)으로 재분류되었다. 또한 이 그룹은 16 종으로 세분화되어 있으며, 그 중 I. mors-panacis를 비롯하여 I. crassa, I. robusta, I. panacis 등이 인삼 뿌리썩음병에 관여하는 것으로 확인되었다(Cabral et al., 2012).
국내에서는 인삼뿐만 아니라 작약, 딸기, 밤나무에서 C. destructans가 분리되었으며(KSPP, 2009; Jun, 2008), 밤나무 근권 토양에서 분리된 I. radicicola 균이 인삼에 병을 발생시킨다는 보고가 있었다(Seo et al., 2018). 또한 작약에서도 C. destructans에 의한 검은뿌리썩음병으로 인해 연작장해가 발생하며(Choi et al., 2004), 최근 Seo et al. (2017b)는 검은뿌리썩음병에 걸린 작약에서 동정된 C. destructans를 I. robusta로 재분류 하였고, 병원성 검정을 통해 인삼에도 병원성이 있음을 확인하였다.
F. solani의 경우, 주로 4∼5 년근 인삼에서 습한 토양으로 인해 약해진 뿌리를 통하여 병이 발생하는 것으로 생각되며, 뿌리썩음을 일으키는 병원균은 F. solani f. sp. pisi로 인삼에 병을 일으키는 것을 확인되었다(Matuo and Snyder, 1972). Fusarium spp.는 인삼뿐만 아니라 종자에 대하여 C. destructans에 비해 상대적으로 병원성이 낮은 것으로 보고되었다(Reeleder and Brammall, 1994; Reeleder et al., 2002).
Lee (2004)는 인삼 뿌리썩음병과 관련된 Fusarium species의 병원성 검정을 통하여 C. destructans가 대체적으로 높은 병원성을 보인 반면에, F. solani는 매우 낮은 비율로 뿌리썩음병 증상을 보였다. 그리고 다른 병원균만을 접종하여 뿌리썩음병 병징이 나타난 부위로부터 재분리 했을 때, 접종한 병원균뿐만 아니라 부생적으로도 분리된다고 하였다. 또한 rDNA-ITS 영역의 유연관계 분석에서는 인삼에서 분리된 균들이 F. solani f. sp. pisi와 F. solani f. sp. radicicola 두 종으로 분류가 되었다(Suga et al., 2000).
본 연구는 6 년근 인삼 수확지의 인삼 뿌리썩음병의 발생현황을 알아보고, 병반에서 분리된 균의 종 동정을 통해 I. radicicola와 F. solani의 재분류하고자 하였다.
재료 및 방법
병 발생상황 조사
국내 인삼 재배지의 뿌리썩음병 발생상황을 조사하기 위해 2017년 인삼 6 년근 수확포장 중 충남 9 개소(당진 3 개소, 홍성 2 개소, 서산 4 개소, 예산 1 개소), 충북 11 개소(괴산 5 개소, 음성 2 개소, 충주 4 개소), 강원 5 개소(춘천 2 개소, 홍천 3 개소)를 대상으로 조사하였다. 조사면적은 포장 당 90 ㎝ x 180 ㎝ (1칸)을 기준으로 3반복 이상에 대하여 인삼의 뿌리썩음병을 조사하였으며, 병반면적은 뿌리썩음병도에 따라 5단계로 나누었다. 병반면적에 따라 0% (무발병) = 0, 1∼30% = 1, 31∼60% = 2, 61∼99% = 3, 100% (결주 혹은 완전부패) = 4로 각각 구분하였다. 그 다음 발병지수(disease severity index, DSI)를 다음 식을 사용하여 환산하였다.
※ DSI=[이병개체수 × (이병도 합/총 개체수)]/총 개체수
이병도 합은 각 단계별 뿌리썩음병 발병등급에 해당하는 발병주수를 곱한 후(발병등급 × 발병주수) 총 합을 계산하였다.
병원균 분리 및 동정
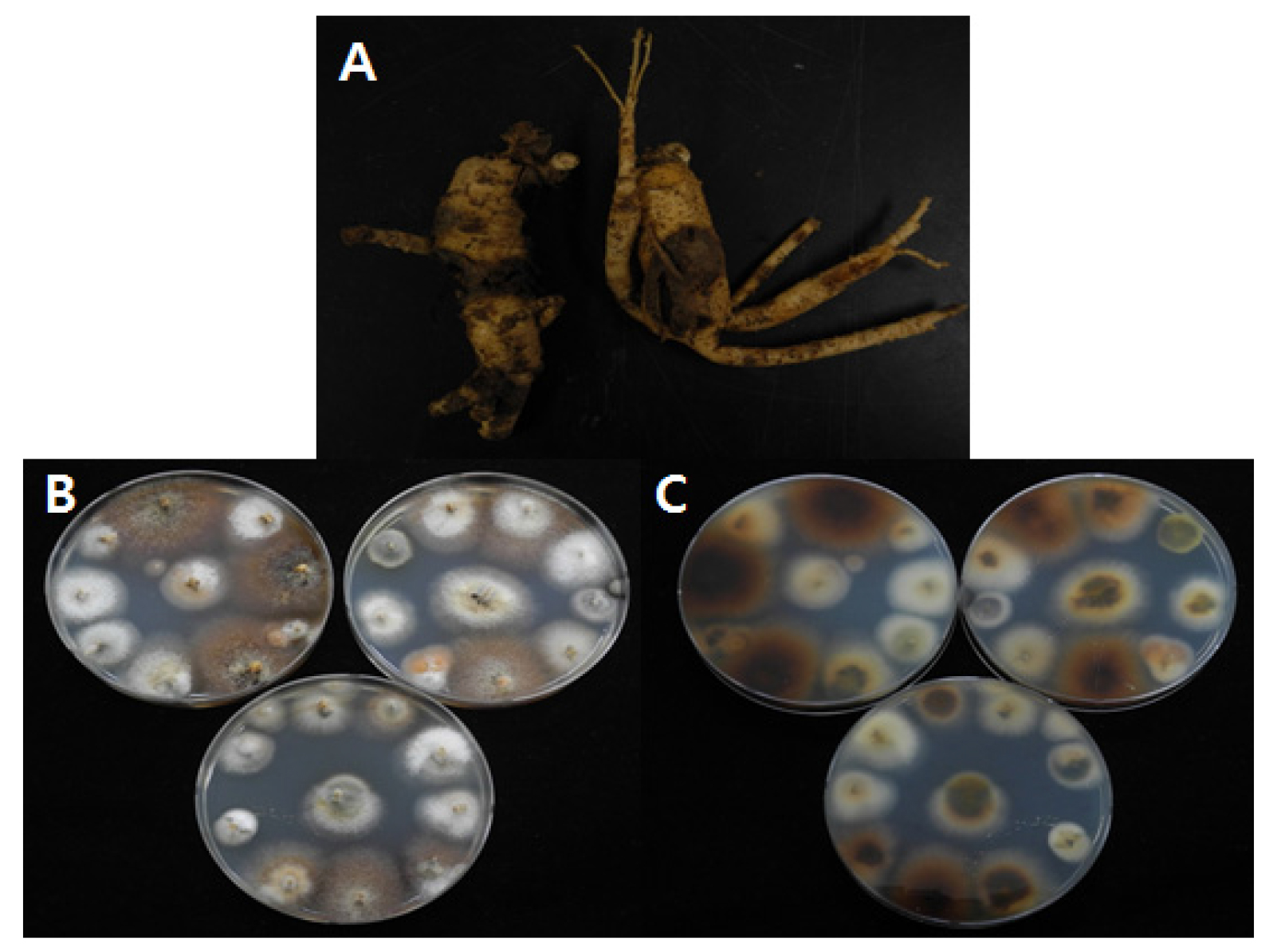
인삼 뿌리썩음병 발생상황 조사를 한 6 년근 수확포장에서 전형적인 뿌리썩음병 증상을 보인 인삼을 채집하여 병반으로부터 균을 분리하였다. 채집한 이병 인삼을 세척하고, 병반부위의 조직을 0.5 ㎝ 크기로 절단하여 1% NaOCl에 1분간 침지로 표면소독을 하였다. 표면소독된 조직을 멸균수로 2∼3회 세척한 후 수분을 제거하였다. 표면소독된 이병 조직을 potato dextrose agar (PDA, 회사) 배지에 치상한 후 15∼20℃에서 7 일간 암배양 하였다. 배양된 조직에서 자란 균사에서 단포자를 분리하여 PDA 배지에서 재분리를 하였다. 분리된 균주는 15℃에 보관하여 추가적인 실험에 사용하였으며, 20% glycerol에 담아 -70℃에 장기보관하였다.
병원균 DNA 추출
분리된 균주들의 genomic DNA를 분리하기 위해 PDA 배지에서 균사를 수거하여 1.5 mL effendorf tube에 넣고 동결건조를 하였다. 동결 건조된 균사를 400 μL의 extraction buffer [0.5% SDS, 30 mM EDTA, 200 mM Tris-HCl (pH 8.0), 200 mM NaCl]와 2×CTAB solution [2% CTAB, 1.4 M NaCl, 1% PVP, 20 mM EDTA, 100 mM Tris-HCl (pH 8.0)]를 섞어준 마쇄한 후, 700 μL의 chloroform : isopropanol (24:1)을 추가적으로 첨가하여 15분 동안 13,000 rpm으로 원심분리를 하였다. 분리된 상등액에 추가적으로 100% ethanol 800 μL로 첨가하고, 10분간 13,000 rpm으로 원심분리하여 genomic DNA를 침전시켰다. 상층액을 제거한 후 70% ethanol 700 μL로 첨가하고 5분 동안 13,000 rpm으로 원심분리를 해서 침전된 DNA를 제외한 물질들을 제거하였다. 최종적으로 ethanol이 완벽히 제거될 때까지 방치시키고, 멸균증류수 50 μL를 넣고 –70℃에 보관하였다(Doyle et al., 1990).
PCR 및 염기서열 분석
인삼 이병조직에서 분리한 병원균의 유연관계 분석을 위해 internal transcribed spacer (ITS) 영역(ITS1-5.8S-ITS4)의 DNA 염기분석을 실시하였다. 대략 520 bp 크기의 ITS 영역의 PCR 증폭은 ITS1, ITS4 primer를 이용하여 annealing 온도 55℃, 35 cycles로 PCR을 수행하였다.
증폭된 PCR 산물은 GenoTech Co. Ltd. (대전)에 염기서열 분석을 의뢰한 후, NCBI (National Center for Biotechnology Information)의 BLAST (Basic Local Alignment Search Tool)을 이용하여 DNA 데이터베이스와 염기서열을 비교하였다. 분석에 사용된 염기서열의 경우, I. radicicola complex는 MH489089, MH489091, MH496586, MK163443 ∼ MK163461, MK170369 ∼ MK170374, F. solani는 MK163464 ∼ MK163495로 NCBI에 등록을 하여 accession number를 부여받았다.
유연관계 분석을 위한 염기서열은 MEGA6 program (Tamura et al., 2013)을 사용하여 alignment를 실시하여 불일치한 염기서열은 분석에서 제외하였고, 1,000 회의 bootstrap 분석을 통하여 신뢰도를 평가하였다.
결과 및 고찰
2017년 인삼 6 년근 수확포장의 인삼 뿌리썩음병 발생현황
인삼 뿌리썩음병의 발생현황 조사를 위해 인삼 6 년근 수확지 총 25 농가를 대상 조사하였다. Fig. 1A와 같이 각 농가당 90 ㎝ x 180 ㎝을 기준으로 3 반복 이상에 대하여 뿌리썩음병 진행 정도에 따라 구분을 지어 이병도 합을 구한 후 이병지수(DSI)를 산출하였다(Fig. 1B).
충북 11 농가의 이병지수는 0.6∼2.7 (평균: 1.46)로 나타냈으며, 충남은 0.3∼2.9 (평균: 1.88), 강원은 0.5∼2.1 (평균: 1.52)로 나타났다. 이병지수가 1.0 이하인 곳은 충주 D, 과산 C, 서산 C, 춘천 B 포장이었으며, 이병지수도 1.0∼2.0인 곳은 14 개 포장으로 가장 많았다. 그리고 7 개의 농가(괴산 D, 당진 A, 당진 B, 서산 B, 서산 D, 예산 A, 홍천 B)에서 2.0∼3.0의 이병지수가 나타났으며, 조사한 25 포장 중 당진 A는 2.9로 이병지수가 가장 높았다(Table 1).
Table 1. The disease severity from root rot of 6 years old ginseng on harvest fields
yDisease severity index.
xAverage of individuals ginseng.
인삼은 묘삼(1년생)을 이식할 때 칸(90 ㎝ × 180 ㎝)당 약 72 주를 심게되는데, 5년간 생육하면서 뿌리썩음병 등 각종 병해에 의한 결주가 발생된다. 조사 포장의 평균 결주율은 44.6%로 확인되었으며, 이병지수가 높은 7 개의 농가[당진 A (DSI: 2.9, 결주율: 68.8%), 당진 B (DSI: 2.6, 결주율: 69.7%), 서산 B (DSI: 2.1, 결주율: 56.5%), 서산 D (DSI: 2.5, 결주율: 61.5%), 예산 A (DSI: 2.3, 결주율: 63.6%), 홍천 B (DSI: 2.1, 결주율: 49.3%)]는 결주율이 높게 확인되었다. 상대적으로 결주가 적은 충주 D (DSI: 0.7, 결주율: 23.3%), 괴산 C (DSI: 0.6, 결주율: 14.6%), 서산 C (DSI: 0.3, 결주율: 15.0%), 춘천 B (DSI: 0.5, 결주율: 31.9%)는 이병지수가 낮게 확인되었다. 이러한 뿌리썩음병에 의한 피해는 초작지 6 년생의 경우 50% 이상 발생한다고 보고가 있었다(Chung, 1972). 또한 인삼 수확 후 3∼4년 경과한 재작지에서는 이병주율이 81.3∼95.2%까지 발생하며, 10 년 이상 경과한 곳에서도 25.6∼30.0% 발생된다는 보고가 있었다(Kang et al., 2007). 본 연구에서도 인삼을 재작할 경우 발생되는 연작장해의 주요 원인인 뿌리썩음병이 토양환경 등 재배환경에 따라 초작지에서도 만연히 발생되고 있는 것이 확인되었다.
인삼 뿌리썩음병 관련 병원균 분리 및 동정
6 년근 수확포장에서 인삼 뿌리썩음병 증상을 보인 인삼을 채집하여 균을 분리하고 이들 중 인삼뿌리썩음병균을 동정하고 분리비율을 확인하였다(Fig. 2). 총 625 균주가 병반으로부터 분리되었으며, 그 중 340 균주는 인삼 뿌리썩음병 관련 병원균(I. radicicola, F. solani)으로 동정되었다. 동정된 인삼 뿌리썩음병 관련 병원균 중 I. radicicola (300 균주)와 F. solani (40 균주)가 각각 48.0%, 6.4% 비율로 동정이 되었으며, 그 외에도 Alternaria sp., F. oxysporum, Trichoderma sp. 등이 인삼 뿌리썩음병반에서 분리되었다(Table 2).
Table 2. The pathogens isolated from root rot of 6 years old ginseng on harvest fields
| Species | Ginseng root rot pathogens | Other fungi | ||
| I. radicicola | F. solani | Total | ||
| No. of isolates | 300 (48.0%) | 40 (6.4%) | 340 (54.4%) | 285 (45.6%) |
인삼 뿌리썩음병의 경우, 여러 가지 원인이 단독이나 복합적으로 작용하여 증상이 다양하고 부패진행 정도에 따라서 흑변이나 갈변현상이 일어난다고 하였으며(Park et al., 2006), I. radicicola 뿐만 아니라 F. solani, Sclerotinia sclerotiorum 등이 인삼 뿌리썩음병에 관여하는 병원균으로 알려져 있다(Shin et al., 2012). 또한 인삼에서 분리된 F. solani는 I. radicicola와 함께 분리빈도가 가장 높지만(Park and Chung, 1997), 병원성보다는 부생성이 매우 강하여 뿌리썩음병이 진전된 병반에서 쉽게 분리되고, 초기 I. radicicola에 의하여 1차 감염을 통해 뿌리썩음병이 발생 후, F. solani가 2차적으로 감염되어 피해를 증가시킬 것으로 판단하였다(Shin et al., 2012). 특히 토양전염병원균인 I. radicicola와 F. solani는 토양 내에 후벽포자를 형성하여 장기간 생존이 가능하며, 인삼 뿌리에 침입하여 공기전염성 병해의 국부적인 병징과는 달리 식물 전체를 고사시키는 전신감염성성 병해를 유발하여 결주의 원인이 되고 있다.
유연관계 분석을 통한 인삼뿌리썩음병균의 종 동정
6 년근 인삼으로부터 분리한 인삼뿌리썩음병균을 분리하여, ITS 영역의 염기서열 분석을 통하여 종 동정을 실시하였다. 먼저 I. radicicola 그룹의 340 균주 중 지역적으로 대표균주 28균주를 선발하여 유연관계를 분석하였다. 27 개의 균주가 I. radicicola 그룹으로 동정되었으며, 1 개의 균주만이(17chu03-01) 근연종인 I. macrodidyma로 확인되었다. I. radicicola 그룹내에서는 강병원성 균주로 알려진 I. mors-panacis (17hon02-01, 17seo02-01)와 상대적으로 병원성이 약한 I. liriodendri (17hong01-01), I. robusta (17gae01-01 등 10 균주), I. cyclaminicola (17eum02-03 등 2 균주)와 I. venezuelensis 근연종인 17chu02-01 등 11 균주가 분류되었다(Fig. 3). 그리고 홍천 C는 I. robusta (17hon02-01)와 I. mors-panacis (17hon02-02), 음성 B는 I. robusta (17eum02-01, 17eum02-02)와 I. cyclamicicola (17eum02-03), 홍성 B의 경우도 I. robusta (17hong01-02)와 I. liriodendri (17hong01-01)과 같이 동일 포장 안에서도 다양한 종이 같이 존재하는 것을 확인하였다. 이는 인삼포장 주변의 기주나 전작물로 인해 유입되었을 가능성이 있으며, 추후 이러한 요인들을 고려하여 인삼 재배지 선정하여야 할 것으로 판단된다.
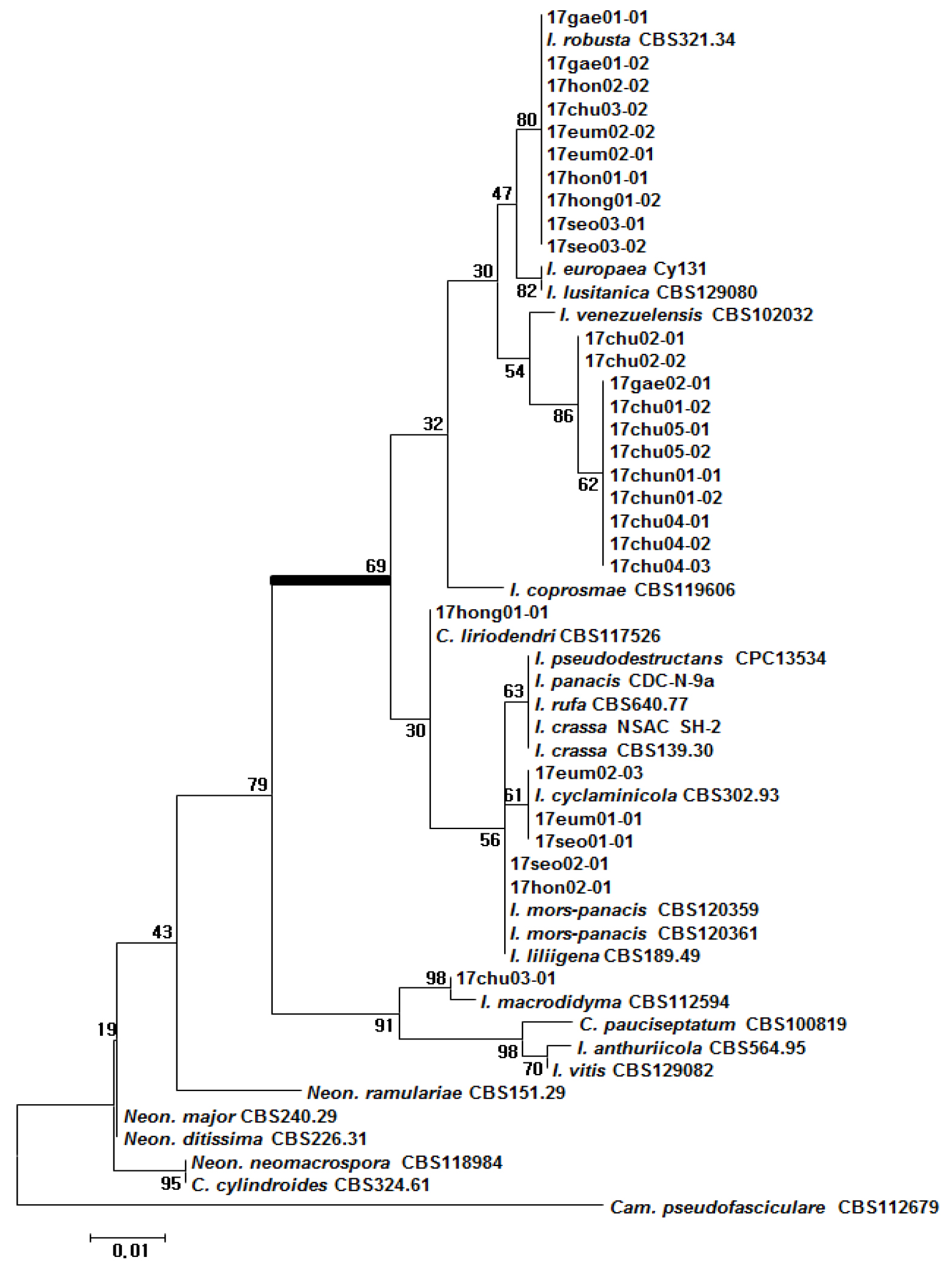
Fig. 3.
Phylogenetic analysis of Ilyonectria radicicola complex isolated from root rot of 6 years old ginseng using ITS region. The unidentified isolates of root rot of 6 years old ginsengs were in the same group as the existing I. radicicola complex. The bootstrap analysis was performed with 1,000 replications. Bold bar is I. radicicola complex.
국내 인삼 뿌리썩음병반에서 분리된 C. destructans의 유연관계 분석을 통해 인삼에서 분리한 그룹뿐만 아니라 다른 기주에서 분리된 C. destructans와도 그룹을 이루는 것을 확인하였으며, 최근 새로운 분류체계에 의해 국내 인삼에서 분리한 종으로 I. mors-panacis, I. liriodendri, I. robusta, I. cyclaminicola와 두 종의 미동정 종이 보고되었다(Seo, 2017a).
또한 F. solani의 경우, 인삼에서 분리한 균주들이 모두 F. solani에 포함되었으며 두 개의 그룹으로 나뉜 것을 확인하였다(Fig. 4).
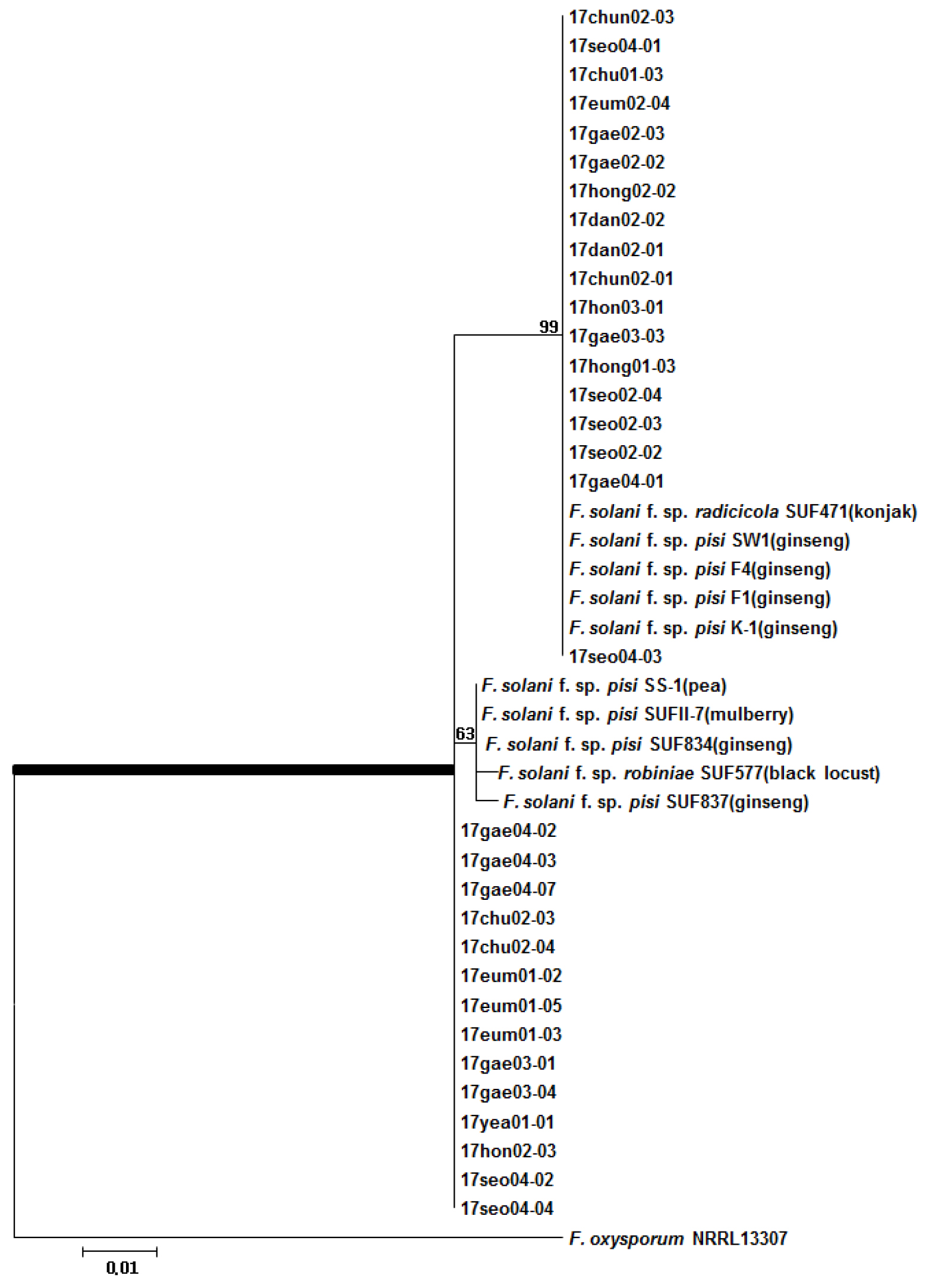
Fig. 4.
Phylogenetic analysis of Fusarium solani isolated from root rot of 6 years old ginseng using ITS region. The unidentified isolates of root rot of 6 years old ginsengs were in the same group as the existing F. solani. The bootstrap analysis was performed with 1,000 replications. Bold bar is F. solani group.
인삼과 곤약으로부터 분리된 F. solani f. sp. radicicola 그룹과 인삼, 아까시나무, 완두콩, 뽕나무에서 분리된 F. solani f. sp. pisi 그룹을 이루었다. 인삼에서 분리된 F1, F4, K1, SW1 균주는 F. solani f. sp. pisi으로 분류가 되었지만(Matuo and Snyder, 1973; Kim and Lee, 1974), 추후 Suga et al. (2000)에 의해 F. solani f. sp. radicicola로 재동정 하였으며, 일본의 인삼에서 분리된 SUF834, SUF837 균주는 F. solani f. sp. pisi로 동정되었다.
인삼 뿌리썩음병을 일으키는 I. radicicola와 F. solani의 기주를 살펴보면 I. radicicola 내에 I. mors-panacis는 오직 인삼에서 분리가 되었으며, I. liriodendri는 포도나무, 사과나무, 튤립, 코르크참나무가 I. robusta는 피나무, 참나무, 인삼, 앵두, 포도나무에서, I. cyclaminicola는 시클라멘에서 분리가 되었다(Cabral et al., 2012). F. solani의 경우에는 F. solani f. sp. radicicola는 곤약, 글라디올러스, 감자에서 분리가 되었으며, F. solani f. sp. pisi는 아까시나무, 완두콩, 뽕나무, 느티나무, 고구마에서 분리되었다(Suga et al., 2000).
따라서 인삼 6 년근 재배지의 인삼 뿌리썩음병을 일으키는 I. radicicola와 F. solani의 종동정과 관련 기주들을 확인함으로써 인삼 재배시 여러 환경요인으로 인하여 다른 기주에 존재하는 병원균이 인삼 재배지로 이동하여 발병 가능성을 유추할 수 있었다.
적요
인삼은 현금작물로 통용되는 약초로 국내에서 매우 중요한 작물 중 하나이다. 인삼의 수확까지 경작 기간은 4∼5년으로 이 기간 동안 여러 토양병원균으로부터 피해를 받게되며, 심할 경우에는 폐포로 경제적 손실을 입게된다. 이러한 뿌리썩음병에 의한 피해 현황을 조사하기 위해 충남, 충북, 강원지역의 6 년근 채굴지 25농가를 대상으로 인삼 뿌리썩음병 발생현황, 발병지수 및 병원균을 분석하였다. 당진 D는 발병도가 2.9로 조사지역 중 가장 높았으며, 괴산 C는 가장 낮은 발병도를 보였다. 인삼 뿌리썩음병의 병반으로부터 병원균을 분리한 결과, 625 균주 중 54.4%가 인삼 뿌리썩음병 관련 병원균인 I. radicicola와 F. solani로 분류가 되었으며, 염기서열을 이용하여 이들 병원균의 유전적 다양성을 확인하였다. 특히 I. radicicola 그룹 내에서도 강병원성 균주로 알려진 I. mors-panacis와 상대적으로 병원성이 약한 I. liriodendri, I. robusta, I. cyclaminicola 등이 동정되었다. F. solani의 경우는 두 개의 그룹으로 구분되어 지나, 추후 다양한 마커를 이용한 유전분석과 병원성 연구를 통해 다양성 연구를 진행해야 할 필요가 있다. 추후 이 결과는 인삼의 뿌리썩음병 진단 및 방제 있어서 기초자료로 활용될 것으로 판단된다.