서언
재료 및 방법
실험재료
추출물 제조
세포 배양 및 세포 생육 억제 활성 측정
SDS-PAGE 및 western blot 분석
Reverse transcriptase-polymerase chain reaction (RT-PCR)
통계분석
결과 및 고찰
먹넌출 추출물 처리에 따른 대장암세포의 세포생존율
먹넌출 열매 추출물의 Cyclin D1 단백질 수준 감소 및 단백질 분해 유도활성
먹넌출 열매 추출물의 GSK3β 유도 Cyclin D1 단백질 분해 Kinase 구명
적요
서언
최근 서구화된 식생활과 환경적 스트레스의 및 고령화의 증가로 인한 암의 발생이 급증하고 있다(Kim and Kim, 2015; Kim et al., 2019). 암은 가장 높은 사망원인을 차지하는 질환으로 알려져 있으며, 암 환자들의 사망률은 전 세계적으로 매년 증가하는 경향을 나타내고 있다(Kim et al., 2012; Kim et al., 2019). 통계학적으로 2006년 대비 2016년도의 암 환자의 수가 48% 증가하였으며, 2020년에는 암 환자가 전 세계적으로 50% 이상 증가 될 것으로 보고되고 있다(Kim et al., 2012; Lanier, 2006; National Cancer Center, 2018; Stewart and Kleihues, 2003).
대장암은 국내외에서 높은 사망률과 증가율을 가진 종양에 속한다(Jemal et al., 2006). 2018년에 발표된 국립암센터 중앙암등록본부 자료에 의하면 2016년에 우리나라에서는 229,180건의 암 환자가 발생했다. 그 중 대장암은 남녀를 합쳐 28,127건으로 전체의 12.3%로 위암 다음으로 2위를 차지했다(National Cancer Center, 2018). 향후 환경오염, 수명연장, 식생활의 변화 등으로 대장암 환자는 증가할 것으로 예상한다. 암에 대한 발병률과 사망률을 감소하기 위한 치료법으로는 외과적 치료, 방사선 요법, 화학 용법 및 면역요법 등이 있으나 치료 후의 부작용과 재발 또는 합병증 등의 문제점이 있다. 따라서 이러한 부작용을 감소시키면서 항암효과를 나타내는 천연 항암 소재개발에 관한 연구가 꾸준히 진행되고 있다(Kim et al., 2019; Lee et al., 2018; Wang et al., 2012).
Cyclin D1은 염색체 11q13에 존재하는 암 유전자로 세포주기의 G1기에서 S기로의 진행에 관여하는 물질이며(Sherr, 1993), Cyclin-dependent kinase (CDK)와 복합체를 형성하여 Retinoblastoma (Rb) 단백질을 인산화시킴으로써 세포증식을 유발하고 종양 발생에 관여한다고 보고되어있다(Dowdy et al., 1993; Han et al., 1999; Lee et al., 2008). 여러 연구에서 알려진 바와 같이 Cyclin D1이 세포주기를 진행하면서 다양한 암에서의 과발현이 암 발생에 중요한 요인이 될 수 있다고 알려져 있다(Gillett et al., 1994; Jiang et al., 1992; Zhang et al., 1993).
본 연구에서 사용된 먹넌출(Berchemia floribunda)은 갈매나무과(Rhamnaceae) 망개나무속(Berchemia)에 속하는 낙엽활엽의 덩굴성 식물로서 지리적으로 우리나라와 일본에 분포하는 수종이다(KNA, 2008; Lee et al., 2003; Song et al., 2014). 먹넌출은 국내에서 충남 안면도의 소나무 숲에서만 자생하고 있어 산림보호법 제18조의2에 따라 특별산림보호대상종으로 지정․관리되고 있으며(Song et al., 2013), 먹넌출 추출물을 이용한 기능성 연구로는 항산화와 미백 연구가 보고 되어있으나 항암 활성에 대한 연구는 미비한 실정이다(Wang et al., 2006). 따라서 본 연구에서는 대장암세포에 대한 먹넌출 추출물의 항암 활성 및 작용기전을 구명하고자 하였다.
재료 및 방법
실험재료
실험에 사용된 대장암 세포주 HCT116과 마우스 대식세포 RAW264.7은 한국세포주은행에서 분양받았고, 대장암 세포의 배양을 위해 사용된 배지인 Dulbecco’s modified Eagle’s medium (DMEM)/F-12 1 : 1 modified medium (DMEM/F-12)는 HyClone (Logan, UT, USA)에서 구매하였다. 특이적 효소 억제제인 MG132, PD98059, SB203580, SP600125, Bay11- 7082, LY294002 및 LiCl과 대장암 세포의 생육억제효능을 평가하기 위한 3-(4,5-dimethylthizaol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT)는 Sigma- Aldrich (St. Louis, MO, USA)에서 구매하였다. Western blot 분석을 위한 항체인 Cyclin D1은 Santa Cruz Biotechnology (Santa Cruz, CA, USA)에서 구입하였고, Phospho-Cyclin D1 (Thr286)과 β- actin은 Cell Signaling Technology (Danvers, MA, USA)에서 구매하였다.
추출물 제조
본 연구에 사용된 먹넌출(Berchemia floribunda)은 2018년 7월 24일에 충청남도 태안군 안면읍에서 채취하였다. 먹넌출은 국립산림과학원 송정호박사의 식물학적 동정을 거쳤으며, 확증표본(표본번호: FMCBrAMD-1807-1-3)은 국립산림과학원 산림약용자원연구소에서 보관하고 있다. 시료를 동결 건조한 후, 파쇄된 먹넌출 시료를 부위별로 각각 열매, 잎, 가지 20 g에 70% 에탄올 400 mL을 첨가하여 상온에서 48시간 동안 교반 추출하였다. 추출 후 filter paper (No. 2, Whatman Co., Maidstone, England)를 사용하여 여과하고, 45℃ 이하의 중탕에서 감압 환류 냉각장치(N-1110S, EYELA, Tokyo, Japan)로 농축 후, 동결 건조하였다. 완성된 시료는 실험 전까지 –80℃로 냉동 보관하였으며, 추출물은 dimethyl sulfoxide (DMSO)에 용해하여 실험에 사용하였다.
세포 배양 및 세포 생육 억제 활성 측정
연구에서 사용된 대장암 세포주인 HCT116 및 마우스 대식세포 RAW264.7은 10% fatal bovine serum (FBS) (Grand Island. NY, USA)와 100 U/mL penicillin and 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 37℃에서 5% CO2 하에서 배양하였다. 시료 처리를 위해 먹넌출의 70% 에탄올 추출물은 DMSO로 용해하였고, 대조구는 DMSO를 0.1%를 초과하지 않는 범위에서 사용하였다. 대장암세포인 HCT116의 증식 억제 평가는 MTT assay로 측정하였다. 대장암 세포인 HCT116, 마우스 대식세포 RAW264.7를 12 well plate에서 well 당 1 × 105 cells로 24시간 배양한 후, 먹넌출 추출물을 농도별로 24시간 동안 처리하였다. 24시간 후 각 well에 MTT (1 ㎎/mL) 용액 200 μL씩 첨가하여 2시간 동안 배양시킨 후, well 바닥에 형성된 formazan이 흩어지지 않게 상등액을 제거하고 DMSO를 1 mL 첨가하여 천천히 녹인 후 UV/Visible spectrophotometer (Lambda 365, PerkinElmer Inc., Waltham, Massachusetts, USA)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
SDS-PAGE 및 western blot 분석
먹넌출 추출물이 처리된 세포에서 단백질을 추출하기 위해서 세포를 1 × phosphate -buffered saline (PBS)로 3회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co., St. Louis, MO, USA)과 phosphatase inhibitor cocktail (Sigma- Aldrich Co., St. Louis, MO, USA)이 포함된 radio immuno precipitation assay (RIPA) buffer (Boston Bio Products, Ashland, MA, USA)를 4℃에서 30분간 처리하여 lysis시켜 단백질을 얻었다. Bicinchoninic acid (BCA) protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 단백질 정량 후, 동일량의 단백질을 10% SDS-acrylamide에 loading하고 NC membrane (Amersham, Freiburg, Germany)에 이동시킨 후 5% non-fat dry milk로 상온에서 1시간 동안 blocking하였다. 1시간 후, 1 차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 14시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척 하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해하여 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL Prime western blotting Detection Reagents (Amersham Biosciences Co., Little Chalfont, UK)를 이용하여 ChemiDoc XRS+System (Bio-Rad inc., Hercules, California, USA)로 단백질을 확인하였다.
Reverse transcriptase-polymerase chain reaction (RT-PCR)
Total RNA 추출은 먹넌출 추출물이 처리된 대장암 세포주 HCT116에 RNeasy Mini kit (QIAGEN GmbH., Hilden, Germany)를 이용하여 수행되었고, cDNA는 1 ㎍의 total RNA를 Verso cDNA kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 제조되었다. PCR은 PCR master mix kit (Promega Co., Madison, WI, USA)를 이용하여 수행되었고, 사용된 primer는 Table 1과 같다.
Table 1.
Sequence of oligonucleotide primers used for RT-PCR
| Gene name | Sequence |
| Cyclin D1 | Forward: 5'-aactacctggaccgcttcct-3' |
| Reverse: 5'-ccacttgagcttgttcacca-3' | |
| GAPDH | Forward: 5'-acccagaagactgtggatgg-3' |
| Reverse: '-ttctagacggcaggtcaggt-' |
통계분석
모든 결과는 3회 반복 측정 후 평균±표준편차로 나타내었고, 처리 간 유의성은 Student’s t-test로 검증하여 p-value 값 이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Excel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
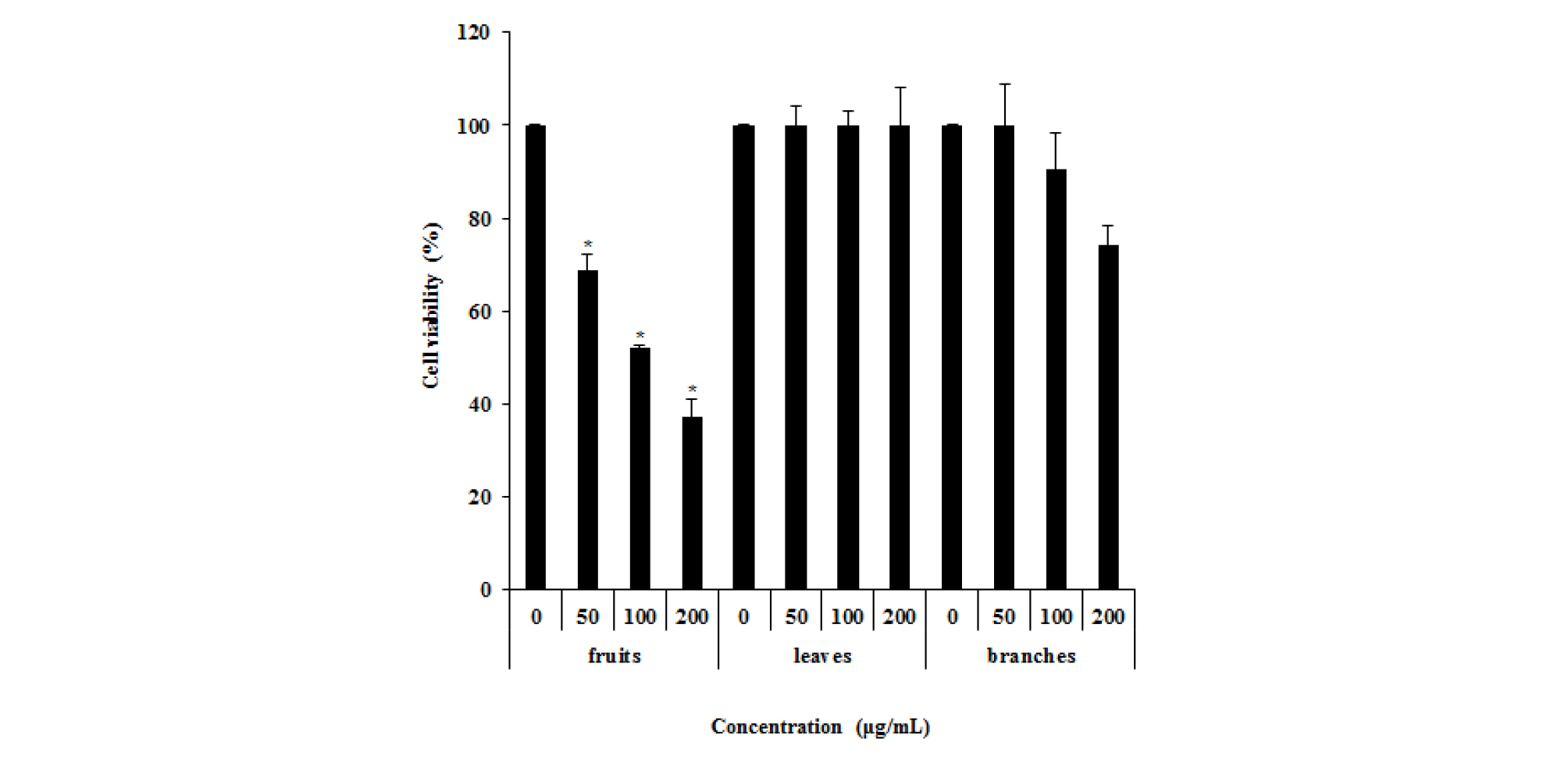
먹넌출 추출물 처리에 따른 대장암세포의 세포생존율
먹넌출 열매, 잎 및 가지의 70% 에탄올 추출물을 이용하여 대장암 세포주인 HCT116의 세포생육억제 활성을 측정하기 위해 MTT assay를 진행하였다. 먹넌출 열매, 잎 및 가지 추출물을 0, 50, 100, 200 ㎍/mL 농도로 처리한 결과 먹넌출 열매에서 HCT116세포의 생육을 농도 의존적으로 억제하였다(Fig. 1).
먹넌출 열매 추출물의 Cyclin D1 단백질 수준 감소 및 단백질 분해 유도활성
다양한 암에서 발암 유전자로 알려진 Cyclin D1은 CDK 4와 6의 복합체를 형성하여(Alao, 2007) G1에서 S기로의 transition을 활성화하여 세포주기의 진행을 조절하며, 암세포에서 비정상적인 세포 생육을 유도한다고 보고되어 있다(Gopalakrishnan et al., 2014; Ogino et al., 2009). 또한 Cyclin D1 단백질의 과 발현은 대장암을 포함한 다양한 암 발생과 밀접한 관련이 있는 것으로 알려져 있으며(Jeong and Lee, 2013; Park et al., 2017; Qin et al., 2015), 대장암 환자의 경우 68.3%에서 과발현 되는 것으로 관찰되어 Cyclin D1의 분해 유도 활성은 대장암 발생과 밀접한 관련이 있다고 알려져 있다(Bahnassy et al., 2004). 먹넌출 열매 추출물이 HCT116세포의 생육억제가 암세포 생장에 관여하는 Cyclin D1의 발현 억제와 관련이 있는지 확인하기 위해 단백질 수준에 미치는 영향을 평가한 결과, 먹넌출 열매 추출물은 농도 의존적으로 감소시켰고. 먹넌출 열매 추출물을 100 ㎍/mL 농도로 처리 후 10시간째부터 Cyclin D1 단백질을 감소시켰다(Fig. 2A and B). 먹넌출 열매 추출물이 Cyclin D1 단백질 수준 감소가 전사조절에 기인하는 것인지 확인하기 위해 먹넌출 열매 추출물이 처리된 대장암 세포주 HCT116에서 RT-PCR을 이용하여 Cyclin D1 mRNA 발현을 확인하였다. 그 결과 먹넌출 열매 추출물은 Cyclin D1 단백질 수준을 감소시키지만 mRNA 수준은 감소시키지 않음을 확인하였다(Fig. 2A).
또한 먹넌출 열매 추출물이 Cyclin D1 단백질 분해를 유도하는지 확인하기 위해 대장암 세포주 HCT116에 단백질 분해효소 억제제인 MG132를 2시간 전 처리 후 100 ㎍/mL 농도에서 먹넌출 열매 추출물을 10시간 동안 처리 후 Western blot을 통해 Cyclin D1 단백질을 확인하였다(Fig. 2C). 그 결과 MG132가 처리된 세포에서는 먹넌출 열매 추출물에 의해 유도되는 Cyclin D1 단백질의 감소가 억제되었다. 따라서 먹넌출 열매 추출물은 Cyclin D1 단백질 분해를 유도할 수 있음을 나타내는 것으로 판단된다.
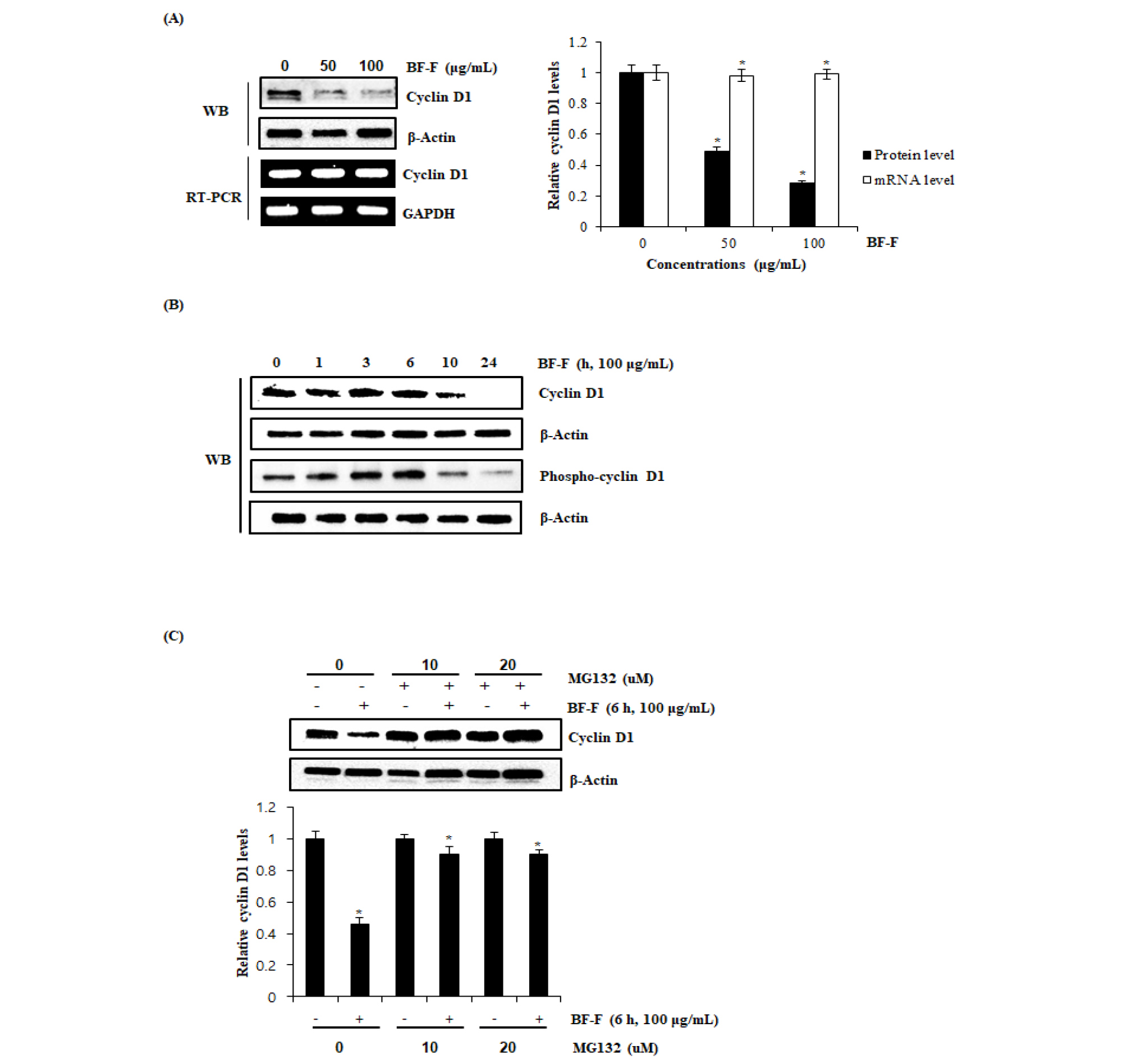
Fig. 2.
Downregulation of Cyclin D1 by BF-F (Fruit of Berchemia floribunda) in HCT116 cells. (A) HCT116 cells were plated overnight and then exposure to BF-F at the indicated concentrations for 24 hours. RT-PCR analysis of Cyclin D1 gene expression, total RNA was prepared after BF-F treatment for 24 hours. GAPDH were used as the internal control. (B) HCT116 cells were treated with 100 ㎍/mL of BF-F for the indicated times. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against Cyclin D1 and Phospho-Cyclin D1. β-actin was used as internal control for western blot analysis. (C) Proteasomal degradation of Cyclin D1 by BF-F in HCT116 cells. HCT116 cells were pretreated with 10 μM and 20 μM of MG132 for 2 hours and then co-treated with 100 ㎍/mL of BF-F for the additional 10 hours.
먹넌출 열매 추출물의 GSK3β 유도 Cyclin D1 단백질 분해 Kinase 구명
먹넌출 열매 추출물에 의해 유도되는 Cyclin D1 단백질 분해 유도와 관련된 Kinase를 구명하기 위해 대장암 세포주 HCT116에 ERK1/2 억제제인 PD98059, p38 억제제인 SB203580, JNK 억제제인 SP600125, GSK3β 억제제인 LiCl, IκK 억제제인 Bay11-7082 그리고 PI3K 억제제인 LY294002를 각각 처리하였다. 억제제 처리 시에는 2시간 전처리 후, 먹넌출 열매 추출물을 10시간 동안 처리하고 Western blot을 이용하여 Cyclin D1 단백질 발현 정도를 확인하였다. 그 결과 대장암 세포주 HCT116에 PD98059, SB203580, SP600125, Bay11-7082, LY294002 처리 시 먹넌출 열매 추출물에 의해 유도되는 Cyclin D1 단백질 수준 감소가 나타났다. 그러나 LiCl이 처리된 HCT116 세포에서는 먹넌출 열매 추출물에 의해 유도되는 Cyclin D1 단백질 감소가 억제되었다. 따라서 먹넌출 열매 추출물에 의한 Cyclin D1의 단백질 분해가 GSK3β 의존성일 수 있음을 확인했다(Fig. 3A~F).
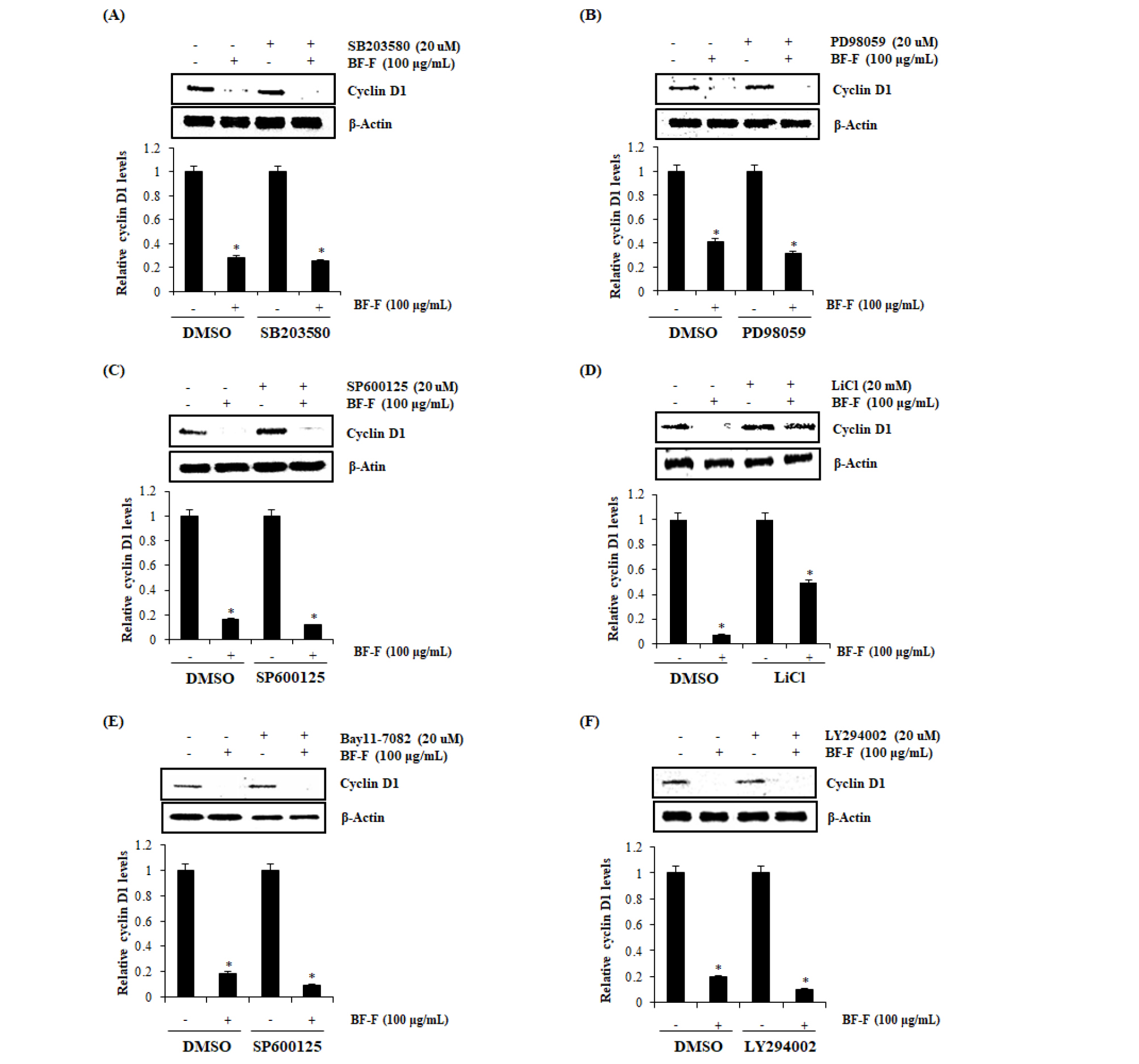
Fig. 3.
Determination of the upstream kinases involved in BF-F mediated Cyclin D1 degradation in human colorectal cancer cells. (A~F) HCT116 cells were pretreated with SB203580 (20 μM) as p38 inhibitor, PD98059 (20 μM) as ERK1/2 inhibitor, SP600125 (20 μM) as JNK inhibitor, LiCl (20 mM) as GSK3β inhibitor, Bay11-7082 (10, 20 μM) as IκK inhibitor or LY294002 (10, 20 μM) as PI3K inhibitor for 2 hours, and then co-treated with BF-F (100 ㎍/mL) for 10 hours. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against Cyclin D1. β-actin was used as internal control for western blot analysis. *P<0.05 compared to cells without BF-F.
Cyclin D1의 Thr286의 인산화와 GSK3β 의존성 CyClin D1 단백질 분해는 서로 관여하는 것으로 알려져 있으며(Alao, 2007), Thr286에서의 인산화는 Cyclin D1의 proteasomal degradation을 일으키는 것으로 알려져 있다(Alt et al., 2000; Yang et al., 2006). 먹넌출 열매 추출물의 Cyclin D1 Thr286 인산화와 LiCl에 의한 GSK3β 억제의 먹넌출 열매 추출물 유도 Cyclin D1 Thr286 인산화에 대한 영향을 평가하였다. 그 결과, 먹넌출 열매 추출물은 처리 6시간에 Cyclin D1의 Thr286을 인산화시켰으며(Fig. 2B), 또한 LiCl은 Thr286 먹넌출 열매 추출물이 매개된 Cyclin D1 인산화를 억제하였다(Fig. 4A). 본 결과는 먹넌출 열매 추출물 Cyclin D1 단백질의 분해는 GSK3β 의존성 Cyclin D1 Thr286의 인산화에 영향을 미치는 것을 알 수 있다.
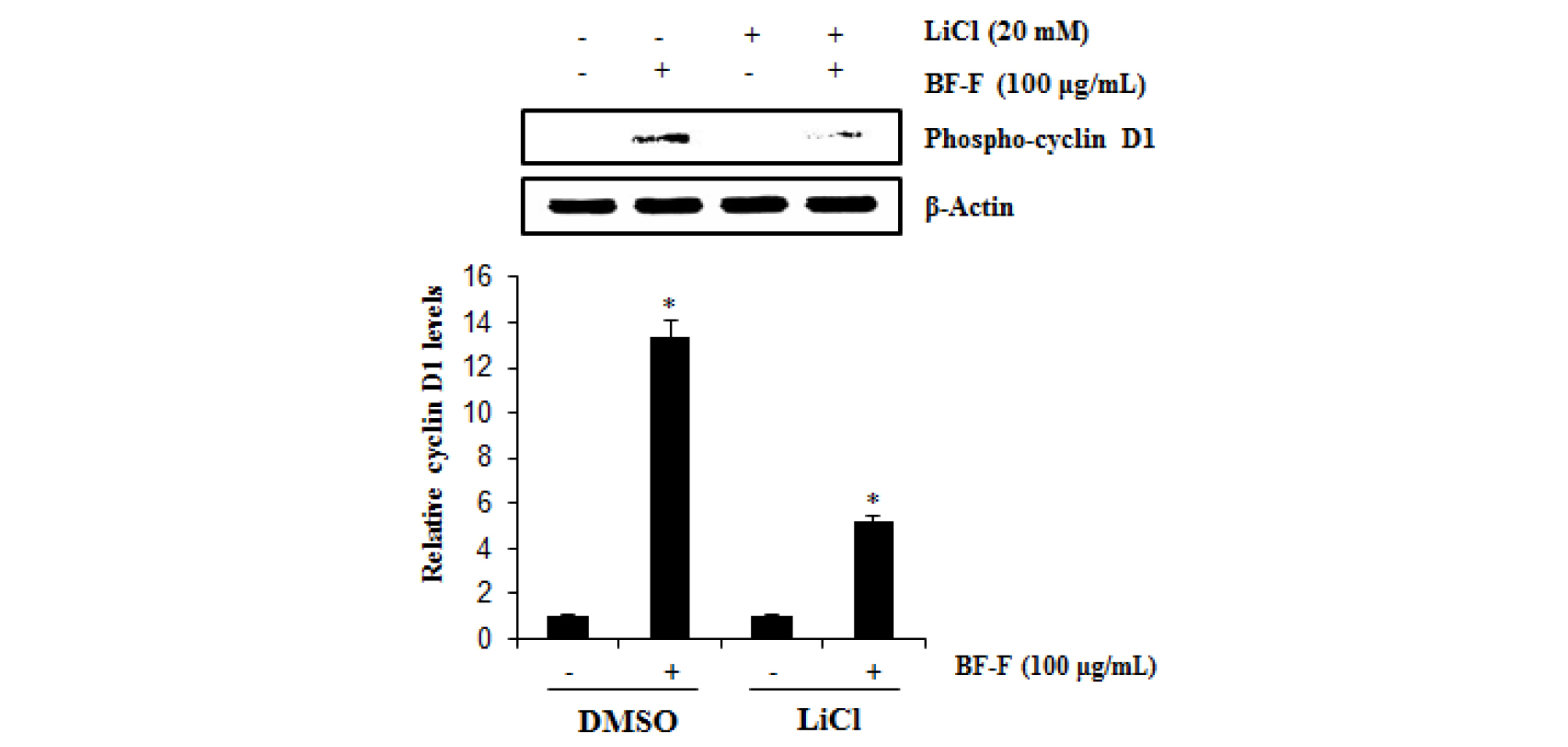
Fig. 4.
HCT116 cells were pretreated with LiCl (20 μM) as a GSK3β inhibitor for 2 hours, and then co-treated with BF-F (100 ㎍/mL) for 6 hours. Cell lysates were subjected to SDS-PAGE and the western blot was performed using antibody against Phospho-Cyclin D1 (Thr286). β-actin was used as internal control for western blot analysis. *P<0.05 compared to cells without BF-F.