서 언
재료 및 방법
실험재료 및 재배관리
질소시비 농도별 처리
수체 생장량 조사
엽 및 토양 성분분석
통계 처리
결 과
질소시비농도에 따른 수체 생장
질소시비농도에 따른 엽 성분 분석
질소시비농도에 따른 토양 성분 분석
고 찰
질소시비농도에 따른 수체 생장
질소시비농도에 따른 엽 토양성분분석
적 요
서 언
우리나라 주요 과수작물 중 하나인 사과(Malus domestica)는 최근 재배면적이 2014년 30,702 ㏊에서 2016년 32,409 ㏊로 증가추세에 있으며(KOSTAT, 2016), 2014년 재배면적 기준 갱신 대상면적은 연간 2,047 ㏊로 이에 따른 사과묘목 수요량은 3,070천주에 달한다(MIFAFF, 2014). 따라서 사과 재배면적 증가와 함께 연간 묘목 수요량은 더욱 증가될 전망이다(KOSTAT, 2015).
저수고 밀식재배 방식에서 간주직경이 굵고 측지가 잘 발생한 우량묘목은 재식초기 생육이 좋고, 강한 골격지를 가지며(Preston, 1968), 조기 결실되어(Van Oosten, 1978), 조기 다수확을 달성하는데 유리하다(Quinlan, 1976; Wertheim, 1978). 또한 Yoon et al. (2000)은 M.9 자근대목의 밀식재배에서 간주직경이 굵고, 측지수가 많은 우량묘목의 재식을 강조하였다. 미국과 이탈리아에서도 간주직경이 13-15 ㎜ 이상 되는 묘목 사용을 추천하고 있으며(Osterreicher et al., 1996), 우리나라는 수고, 간주직경, 측지수에 대한 묘목의 기준을 종자산업법으로 정하여 우량묘목 사용을 권장하고 있다(MAFRA, 2016).
사과묘목은 대목에 접수를 접목한 후 묘 포장에서 1년간 육묘하여 생산하고 있으나(Hartmann et al., 1990), 동일한 포장에서 연작을 하게 되면 수체의 수고, 간주직경 등이 감소하여 묘목 생육이 불량해지는 연작장해가 발생한다(Kviklys et al., 2008; Mazzola and Manici, 2012; Pacholak et al., 2004). 이러한 연작장해의 원인은 다양한 토양 미생물과 묘목 굴취 과정에서 뿌리가 절단되어 발생하는 hydrogen cyanide (HCN) 등으로 알려져 있다(Benizri et al., 2005; Rumberger et al., 2007). 연작장해의 원인을 제거하는 방법으로 재식 전 토양소독을 위한 methyl bromide 훈증과 acetic acid와 Bacillus subtilis 관주, 녹비작물의 시용, 근권 주변 독성물질 제거를 위한 재식구덩이 내 유기물 및 인산 시용 등이 있으며, 연작장해 예방을 위한 방법으로는 새로운 토양에서 묘목을 생산하는 이동재배 방식이 있다(Jackson, 1973; Jung et al., 2015; Nielsen, 1994; Utkhede et al., 2001; Wertheim, 1998; Wilson et al., 2004). 한편 포트를 활용한 묘목생산 방법은 사용되는 상토를 매번 새롭게 교체해 줌으로써 연작장해를 예방할 수 있고 고정된 시설하우스를 지속적으로 이용할 수 있으며(Flemer, 1980), 관수 또는 관비 시스템을 갖춰 수분과 시비를 효율적으로 관리하여 품질이 균일한 묘목을 생산할 수 있다는 이점이 있어 사과 포트묘목 생산방식의 도입이 필요하다(Poffley, 2004).
일반적인 사과묘목 포장은 초밀식 재배하기 때문에 사과원보다 50-100% 더 많은 시비를 하고 있다(Kim and Yoon, 1998). 사과묘목 생산에 사용되는 비료 성분 중 질소는 식물에서 가장 많은 비중을 차지하는 무기영양원소이며(Crawford et al., 2000), 아미노산, 핵산 등 식물의 생장과 발달에 직·간접적으로 관여하기 때문에 다른 비료성분에 비하여 수체 생장에 미치는 영향이 매우 크나(Coruzzi and Last, 2000) 질소시비와 포트묘목의 수체 생장과 관련된 연구는 미흡한 실정이다. 또한 질소는 토양에서 수소이온을 방출하여 칼리, 칼슘, 마그네슘 등의 함량에 영향을 미치고 이와 관련된 길항관계에 있는 다른 무기영양원소에 대한 식물체의 흡수량에 변화를 가져오며, 잎의 무기성분 함량과 토양의 화학성에 영향을 준다(Belton and Goh, 1992; Park et al., 1999; Rowell, 1994). 하지만 일반 사과원을 대상으로 한 잎의 무기성분 함량의 적정범위만 조사되었을 뿐 포트묘목에 대한 적정범위는 설정되어 있지 않으며(Lee et al., 2002) 포트내 토양의 화학성에 대한 안정성을 확인할 필요가 있다.
따라서, 본 연구는 질소시비농도에 따른 사과 ‘후지’/M.9 포트 묘목의 수체 생장을 조사하여 포트 우량묘목 생산을 위한 적정 질소시비 수준과 이를 기준으로 한 잎의 무기성분함량의 적정범위를 제시하고, 토양 화학성의 안정성을 확인하고자 수행하였다.
재료 및 방법
실험재료 및 재배관리
본 시험은 충청북도 청주시 소재 충북대학교 부속농장 무가온 온실(36°37'28.6"N, 127°27'16.2"E)에서 수행하였다. 시험에 사용된 접목묘의 대목은 길이 35-40 ㎝, 직경 11-12 ㎜이며, 접수는 길이 5-7 ㎝, 직경 7-8 ㎜로 전체길이가 40-47 ㎝로 당해에 접목된 ‘후지’/M.9 묘목이었다. 상토는 원예용상토(Seoul bio, Suncheon, Korea), 코코피트(GFC. Co., Hongseong, Korea), 피트모스(Peltracom, Arles, France), 펄라이트(GFC. Co., Hongseong, Korea)를 1:1:1:1 비율로 혼합하였으며, 토양 3상은 고상 35.8%, 액상 38.2%, 기상 26.0%의 분포를 보였다. 식재는 원형 플라스틱 포트 46.8-L (Diameter × Height, 36 ㎝ × 46 ㎝)에 상토를 채우고 각 포트마다 묘목 1주를 지상부가 20 ㎝ 정도 노출되도록 하였다.
1년차 실험은 2015년 6월 8일부터 2015년 11월 18일까지였으며, 2년차 실험은 재현성 확인을 위해 2016년 4월 5일부터 2016년 11월 18일까지 진행하였다. 관수는 1일 관수량을 포트 용적의 2.3%로 하였을 때 M.9 대목의 생장이 가장 좋았던 것을 기준하였으며(Atkinson et al., 1999), 토양의 수분을 적정수준으로 유지할 수 있도록 3-4일 주기로 평균 주 2회 관수하였고, 1회 관수량은 3-4 L였다. 또한, 기상과 토양의 수분 상태에 따라 관수량을 주 1회 가감하는 경우가 있었으며, 관수와 시비가 같은 날이 되지 않도록 하였다.
일소피해 예방을 위해 매년 6월 9일부터 9월 9일까지 흑색 차광망을 이용하여 0%(무차광, 900 μmol・m-2・s-1 내외) 대비 70% 차광하였고, 도복을 방지하기 위해서 수고가 약 50 ㎝ 정도 되었을 때 지주를 설치하였으며, 수체 생장에 맞춰 지주끈으로 수체를 고정하였다. 병해충 방제는 농촌진흥청 사과연구소의 9회 방제력을 따랐다(RDA, 2013).
질소시비 농도별 처리
질소 중 질산태 질소는 묘목의 영양생장을 증가시키고 암모니아태 질소는 측지발생을 증가시킨다고 하였으며, 질산태와 암모니아태 질소를 혼합하여 시비한 묘목과 단일형태로 시비한 묘목의 영양생장과 측지발생량은 차이가 없었다는 선행연구 결과를 기준으로 질산태와 암모니아태 질소를 혼합하였다(Gao et al., 1992). 처리구는 농촌진흥청에서 제시한 사과원 토양영양성분 기준을 참조하여 질소시비농도 8 mM을 기준으로 하였으며(RDA, 2013), 질소시비는 질산칼륨 1 mM과 인산암모늄 1 mM에 나머지는 질산칼슘 4수염을 혼합하여 질소시비농도를 4, 8, 16, 32 mM로 처리하였다(Table 1). 질소비료에 포함된 인, 칼리의 양은 고정적이었으며, 칼슘을 제외한 무기영양원소는 MgSO3 1.5, H3BO3 0.05, MnSO4 0.01, ZnSO4 0.001, CuSO4 0.0003, Na2MoO4 0.0001, Chelate (Fe 13%) 0.06 mM로 동일하게 투입하였다(Gao et al., 1992). 시비방법은 관주로 접목묘 활착을 확인 후 시작하여 1년차에는 6월 22일부터 11월 18일까지 주 2회 총 38회 실시하였으며, 2년차에는 4월 26일부터 11월 18일까지 주 2회 총 60회 실시하였다.
Table 1. Composition of nitrogen sources used in this study
| Nutrient | Treatment (mM) | |||
| 4 | 8 | 16 | 32 | |
| Ca(NO3)2・4H2O | 1z (2)y | 3 (6) | 7 (14) | 15 (30) |
| NH4H2PO4 | 1 (1) | 1 (1) | 1 (1) | 1 (1) |
| KNO3 | 1 (1) | 1 (1) | 1 (1) | 1 (1) |
yMean concentration of nitrogen.
1, 2년차 실험구 배치는 처리당 1주를 1반복으로 완전임의배치 6반복으로 하였으며, 수체 생장 조사로 3반복을 이용하였고, 나머지 3반복은 뿌리생장, 건물중, 엽 분석에 이용하였다.
수체 생장량 조사
1년차(2015년) 생장량 조사는 활착이 확인된 6월 22일부터 처리구별 생장이 균일한 묘목을 3주 선정하여 농촌진흥청 농업과학기술 연구조사분석기준(RDA, 2012)에 따라 수고, 간주직경, 측지생장, 엽생장, 뿌리생장, 건물중 등을 조사하였다. 2년차(2016년) 생장량조사는 활착이 확인된 4월 26일부터 처리구별 생장이 균일한 묘목을 3주 선정하여 수고, 간주직경, 측지생장량을 조사하였으며, 조사방법은 1년차와 동일하게 하였다.
1년차 수고는 7월 29일부터 11월 18일까지 지상부 전체의 길이를 조사기간 중 월 2회 조사하였으며, 2년차에는 5월 18일부터 11월 18일까지 조사기간 중 월 1회 조사하였다.
1, 2년차 간주직경과 측지생장은 11월 18일 각각 조사하였다. 간주직경은 접목부 상단 10 ㎝ 지점을 버니어 캘리퍼스(CD-15CP, Mitutoyo, Tokyo, Japan)로 측정하였으며, 측지생장량은 지제부 60 ㎝ 이상에서 발생한 길이가 2 ㎝ 이상 되는 측지를 대상으로 전수조사하였고, 측지 총 생장량은 조사대상 측지길이의 총 합으로 하였으며, 측지수는 길이 15 ㎝ 이상 생장한 측지의 수를 조사하였다.
엽생장은 2015년 11월 18일에 조사하였으며, 엽수는 엽장 1 ㎝ 이상의 잎을 전수조사하였고, 엽면적은 수고 중간지점에서 처리당 3주, 주당 2엽을 채취하여 처리당 6매를 평균하였으며 엽면적계(LI-3000A, LI-COR, Inc., Nebraska, USA)를 이용하여 측정하였다.
뿌리생장 및 수체건물중은 2015년 10월 19일에 처리구별 수고 조사대상 묘목을 제외한 3주를 굴취하여 농촌진흥청 농업과학기술 연구조사분석기준에 따라 조사하였다(RDA, 2012).
뿌리생장은 근장, 근수를 조사하였다. 근장은 주근의 길이를 측정하였고, 근수는 뿌리직경 Ø1 ㎜ 이상의 뿌리를 대상으로 전수조사하였다. 수체 건물중은 잎, 줄기, 뿌리로 구분하여 측정한 후 합산하였다. 잎은 지상부 전체를 대상으로 하였으며, 줄기는 접수의 기부로부터 생장한 전체를 대상으로 하였고, 뿌리는 대목의 기부로부터 생장한 뿌리를 대상으로 하였다. 채취한 시료는 0.3% 빙초산과 증류수로 세척한 후 열풍식 건조기에서 70℃로 잎과 뿌리는 3일간, 줄기는 7일간 건조시킨 후 건물중을 측정하였다.
엽 및 토양 성분분석
잎 성분분석은 2015년 10월 19일에 건물중을 측정한 시험주를 농업과학기술 연구조사분석기준에 준하여 분석하였다(RDA, 2012). 잎은 신초 중간부위에서 주당 건전엽 60매를 채취하였으며, 채취한 시료를 40 mesh 정도로 분쇄하여 사용하였다.
수체시료는 처리구당 3주를 3반복으로 분석하였으며, 분해는 습식분해법을 이용하여 500 mL 분해용 플라스크에 시료 0.5 g과 분해액(H2SO4 1 mL, 50% HClO4 10 mL)을 넣고, 서서히 가열하다가 차츰 온도를 올려 310-410℃에서 분해시켜 얻은 액을 식힌 후 Whatman No.6 여과지(WF6-1100, Whatman P.I.C., UK)로 100 mL 메스플라스크에 여과한 후 여과액을 사용하였다. 질소는 질소분석기(Vario MAX CN, Elementar, Langenselbold, Germany)를 이용하여 Kjeldahl법으로 분석하였고, 인은 분광광도계(Cary 100 UV/Vis., Agilent Tec., Santa Clara, USA)를 사용하여 Vanadate법으로 분석하였다. 칼리, 칼슘, 마그네슘은 inductively coupled plasma (Optima 3000 spectrometer, U.S. Instrument division, Norwalk, USA)로 분석하였다.
토양 성분분석은 수체 성분분석용 시료를 굴취한 포트의 중간 깊이인 20 ㎝ 부위 흙을 Auger로 채취하여 그늘에서 풍건시킨 후 20 mesh 체를 통과시켜 농업과학기술 연구조사분석기준에 준하여 분석하였다(RDA, 2012). pH는 삼각 flask에 정제된 토양시료 5 g과 증류수(25 mL)를 넣고 저어주면서 1시간 방치 후 상등액을 pH meter (HI-8424, Hanna ins., Woonsocket, USA)로 측정하였다. 유기물은 시료를 마쇄하여 0.5 ㎜ 체눈을 통과시킨 후 토양 0.1-1.0 g에 분해액(0.4 N K2Cr2O7 10 mL)을 넣어 200℃의 전열판(Daihan Scientific, Bangkok, Thailand)에서 기포발생 후 5분간 반응시키고, 증류수(150 mL)와 인산(85% H3PO4 5 mL) 및 지시약을 넣고, 적정액[0.2 N FeSO4(NH4)2SO4]으로 적정하였으며, 무기영양원소는 수체 영양성분분석과 동일하게 하였다.
통계 처리
통계 처리는 SAS 프로그램(SAS 9.4 SAS Institure Inc, Cary, NC, USA)을 이용하여 5% 유의수준에서 던컨의 다중검정방법(Duncan’s multiple range test)을 수행하였다.
결 과
질소시비농도에 따른 수체 생장
질소시비농도가 사과 ‘후지’/M.9 포트 묘목의 수체 생장에 미치는 영향을 조사하기 위해 수고, 간주직경, 측지생장을 측정하였다.
수고는 1년차(2015년), 2년차(2016년)의 생육기간 중 동일한 패턴으로 생장하였으며, 11월 18일에 최종 수고를 측정하였다(Fig. 1). 1년차, 2년차 모두 16 mM 처리구에서 각각 190.3, 228.3 ㎝로 컸고, 32 mM에서 184.0, 220.2 ㎝로 작았으며, 4 mM에서 각각 180.7, 215.7 ㎝로 작아 유의적인 차이를 보였으며, 1년차와 2년차 실험 모두 비슷한 경향이었다. 또한, 2015년 9월 23일과 2016년 8월 18일에 모든 처리구에서 우량묘목 기준인 140 ㎝ 이상의 생장을 보였다.
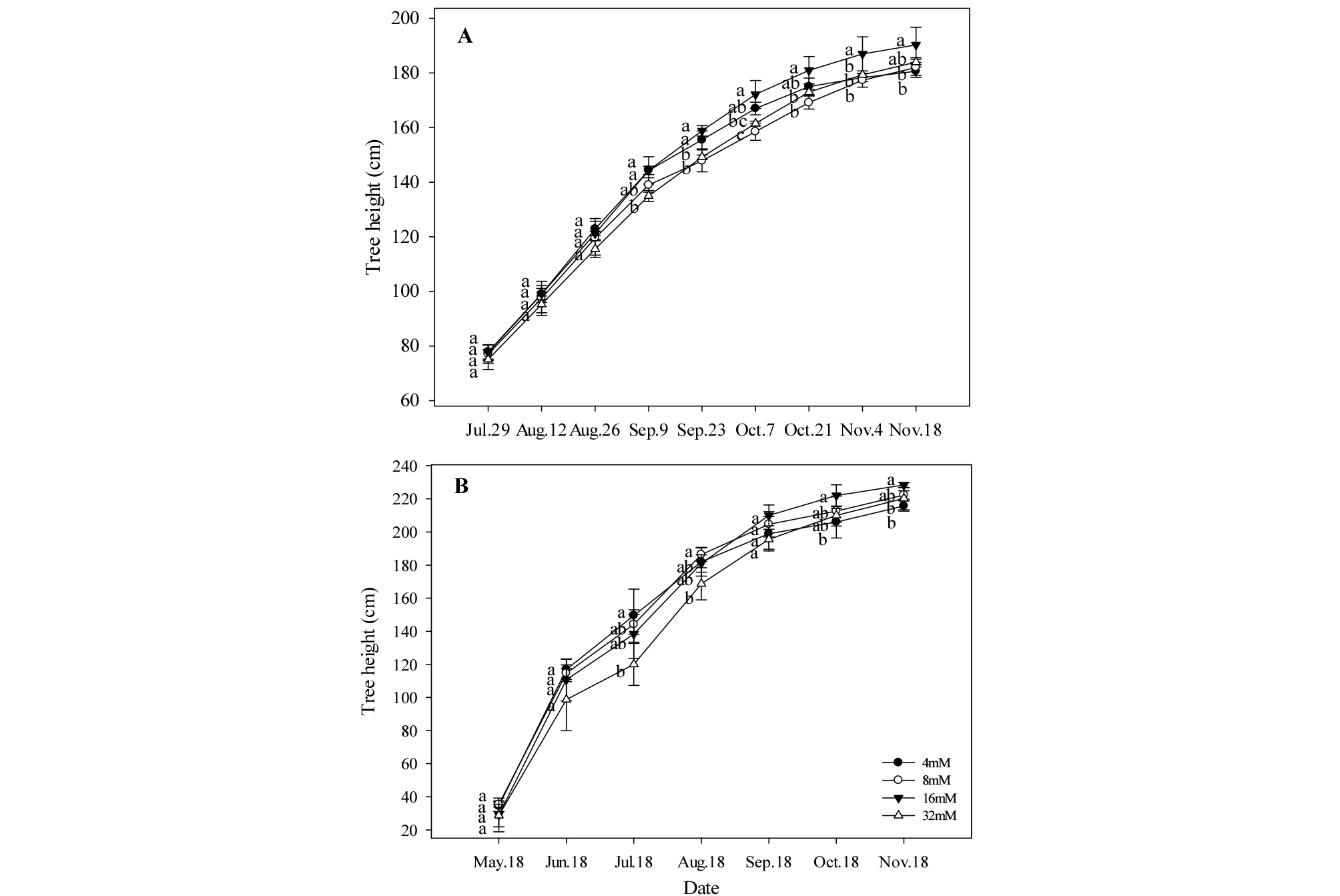
Fig. 1.
Tree height of one-year-old ‘Fuji’/M.9 apple potted trees under four different concentrations of nitrogen fertilization during experimental period in 2015 (A) and 2016 (B). Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
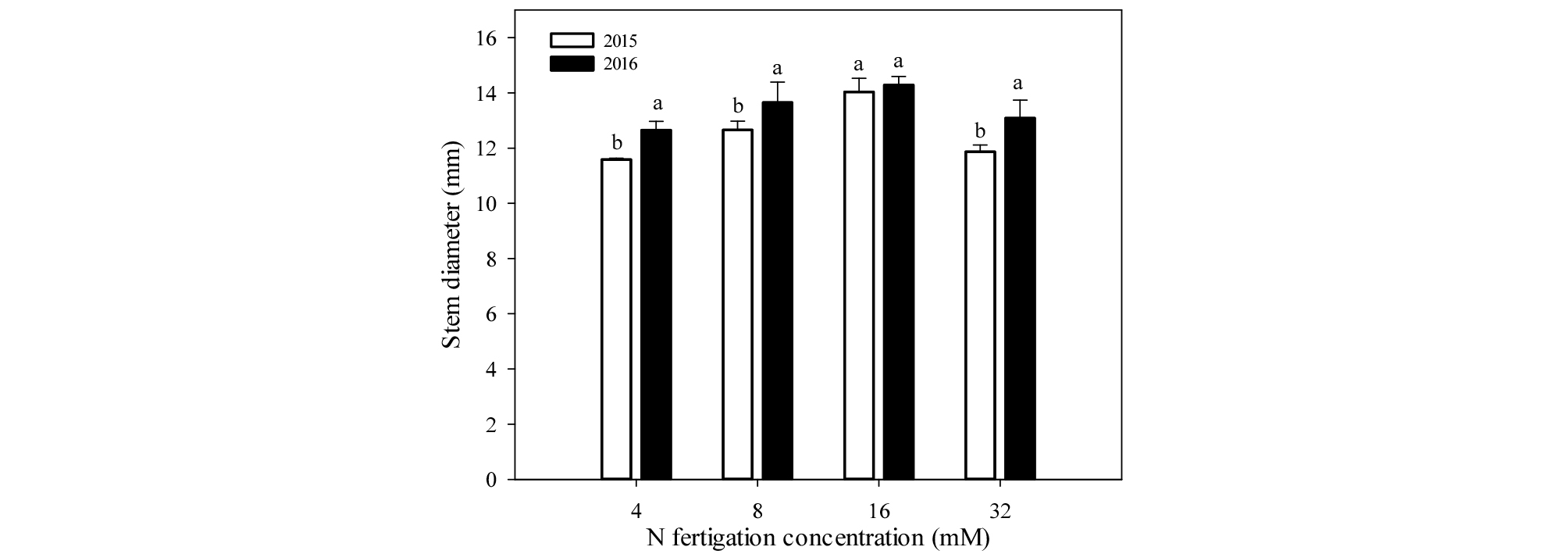
간주직경은 1년차에는 16 mM처리구에서 14.0 ㎜로 유의적으로 굵었고, 다른 처리구에서 유의적인 차이는 없었다(Fig. 2). 2년차에는 모든 처리구에서 유의적 차이가 없었다. 또한, 우량묘목 기준인 12 ㎜ 이상의 생장을 보인 처리구는 1년차에서 8, 16 mM 처리구였으며, 2년차에는 모든 처리구가 해당되었다.
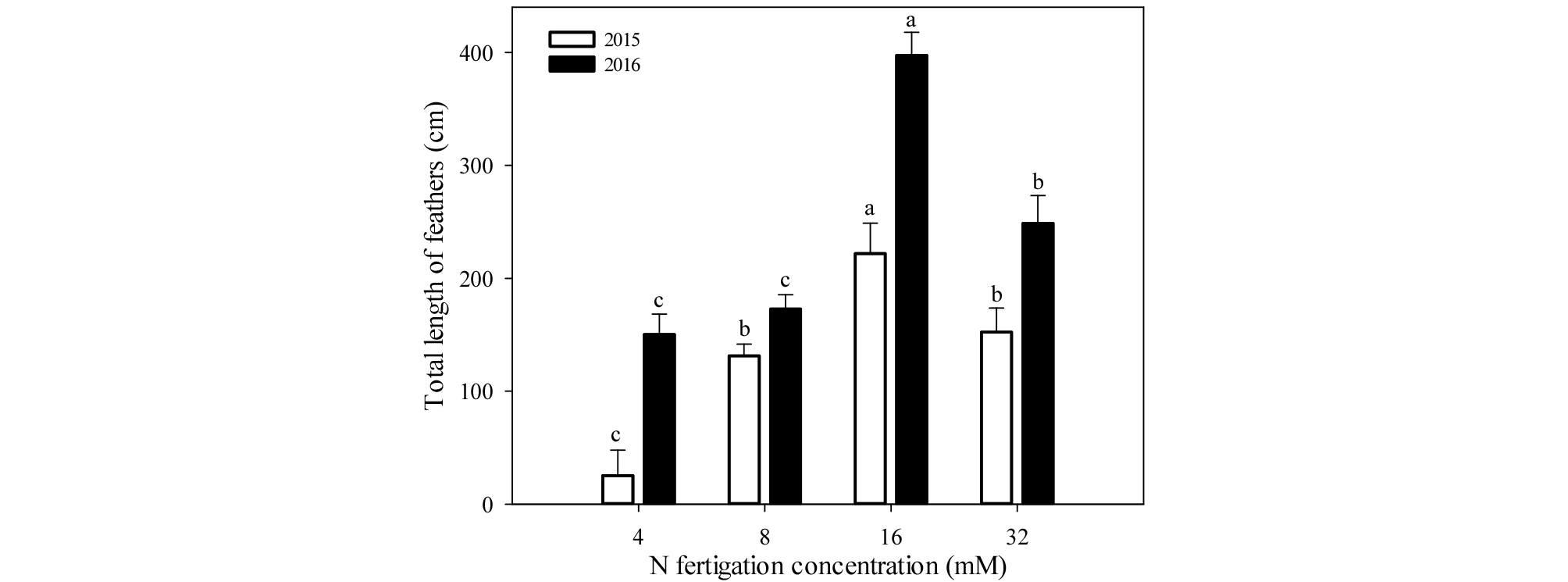
측지생장은 측지 총생장과 길이 15 ㎝ 이상의 측지수를 조사하였다(Figs. 3, 4). 측지 총생장은 1년차와 2년차 모두 16 mM에서 각각 222.0, 397.3 ㎝로 가장 높았으며, 4 mM에서 각각 25.3, 150.2 ㎝로 가장 낮았다. 1년차에서 15 ㎝ 이상 측지 수는 16 mM에서 4.0개로 가장 많았으며, 다른 처리구 사이는 유의적 차이가 없었다. 2년차에는 8, 16, 32 mM에서 유사하게 많았으며, 4 mM에서 4.0개로 가장 적었다. 측지 총생장과 15 ㎝ 이상 측지 수는 1년차와 2년차 모두 유사한 경향을 보였으며, 우량묘목 기준인 15 ㎝ 이상의 측지 5개 이상 발생을 보인 처리구는 2년차의 16, 32 mM 처리구였다.
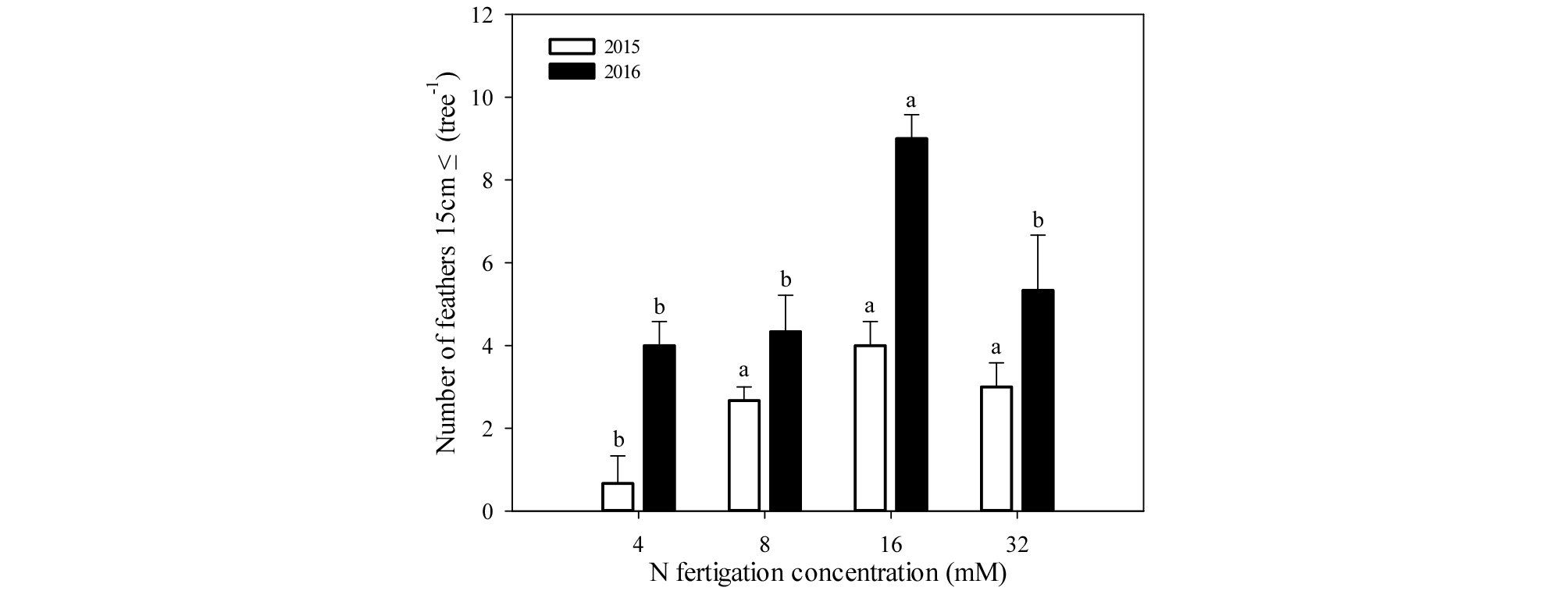
Fig. 4.
Number of feathers of more than 15 cm-sized of one-year-old ‘Fuji’/M.9 apple potted trees under four different concentrations of nitrogen fertilization on November 18, 2015 and 2016. Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
질소시비농도가 사과 ‘후지’/M.9 포트 묘목의 수체에 미치는 영향을 조사하기 위해 엽수, 엽면적, 근장, 근수, 수체 건물중을 측정하였다.
엽수는 16 mM 처리구에서 161.7장으로 가장 많았고, 8, 32 mM에서 각각 125.3, 131.7장으로 중간 정도였으며, 4 mM에서 79.3장으로 가장 적었다(Fig. 5). 엽면적은 8, 16 mM에서 각각 89.9, 95.6 ㎝2로 컸고, 4, 32 mM에서 각각 74.1, 78.8 ㎝2로 작았다(Fig. 5).
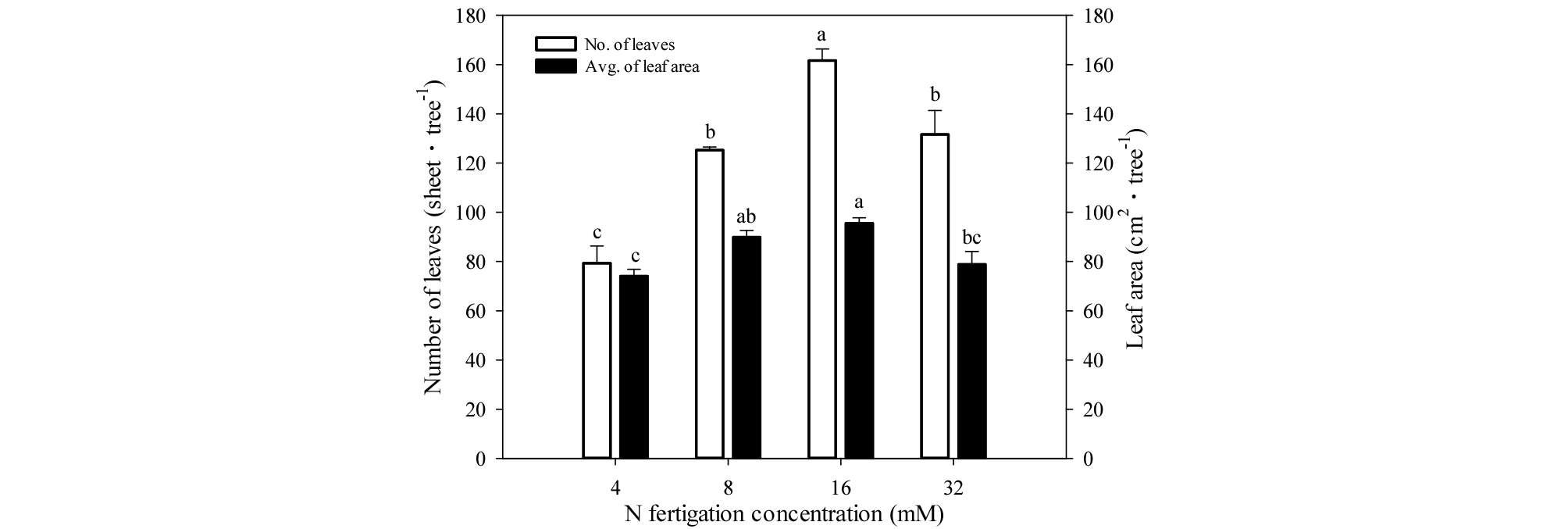
Fig. 5.
Number of leaves and leaf area of one-year-old ‘Fuji’/M.9 apple potted trees under four different concentrations of nitrogen fertilization in 2015. Number of leaves was measured on November 18, 2015. Leaf area was measured 6 sheets per tree on November 18, 2015. Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
뿌리생장은 근장, 근수, 근생체중, 근건물중을 측정하였다(Table 2). 근장은 시비 농도가 낮을수록 길어져 4 mM처리구에서 103.8 ㎝로 가장 길었으며, 32 mM에서 84.9 ㎝로 가장 짧았다. 근수는 4, 16, 32 mM에서 40.3-54.7개로 유사하게 많았으며, 8 mM에서 32.0개로 적었다. 근생체중은 4 mM 처리구에서 61.6 g으로 가장 높았으며, 8 mM에서 22.5 g으로 가장 낮았다. 근건물중 또한 4 mM에서 13.8 g으로 가장 높았으며, 8 mM에서 7.6 g으로 가장 낮았다. 16, 32 mM 처리구는 근생체중과 근건물중에서 중간 정도였다.
Table 2. Root growth of one-year-old 'Fuji'/M.9 apple potted trees under four different concentrations of nitrogen fertilization on October 19, 2015
수체 건물중은 16, 32 mM 처리구에서 각각 122.1, 113.9 g・tree-1으로 가장 높았고, 8 mM에서 104.1 g・tree-1으로 중간 정도였으며, 4 mM 처리구에서 86.7 g・tree-1으로 가장 낮았다(Fig. 6).
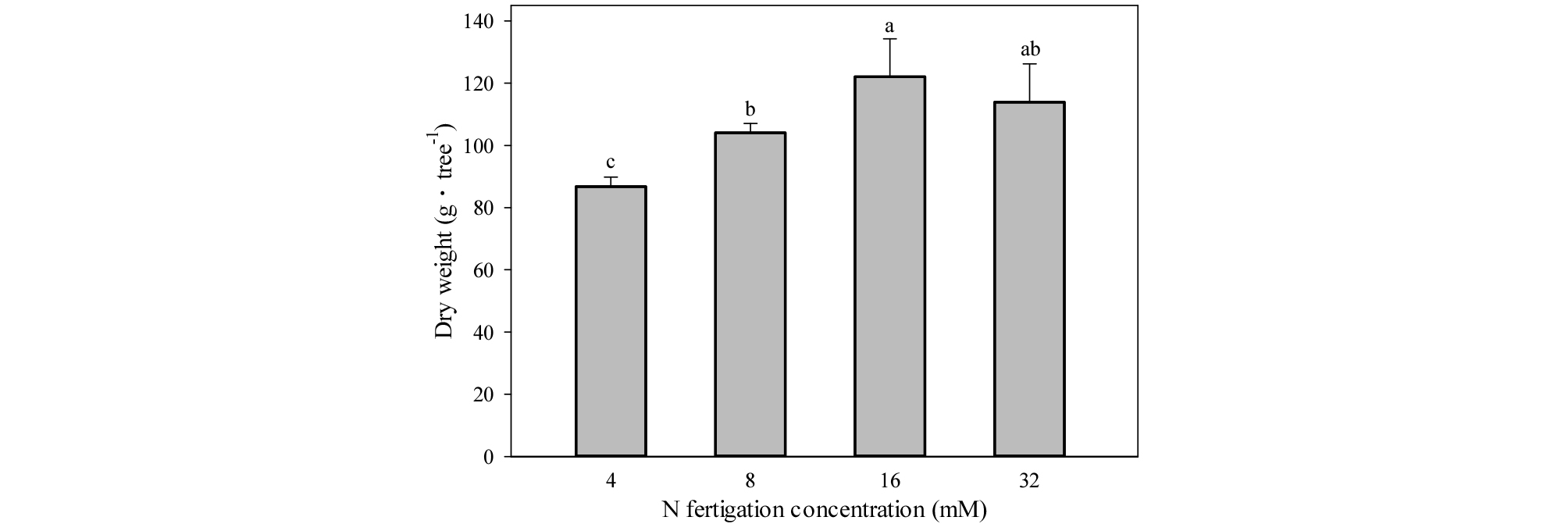
Fig. 6.
Dry weight of one-year-old ‘Fuji’/M.9 apple potted trees under four different concentrations of nitrogen fertilization in 2015. The trees were sampled on October 19, 2015. Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
질소시비농도에 따른 엽 성분 분석
잎의 질소 농도는 8, 16, 32 mM 처리구에서 유사하게 높았으며, 4 mM 처리구에서 가장 낮았다(Fig. 7). 잎의 인 농도는 16, 32 mM에서 8.4 g・㎏-1・tree-1으로 유사하게 높았으며, 4 mM에서 6.2 g・㎏-1・tree-1으로 가장 낮았다. 잎의 칼리, 칼슘, 마그네슘 농도는 처리구별 유의적 차이가 없었다(Fig. 8).
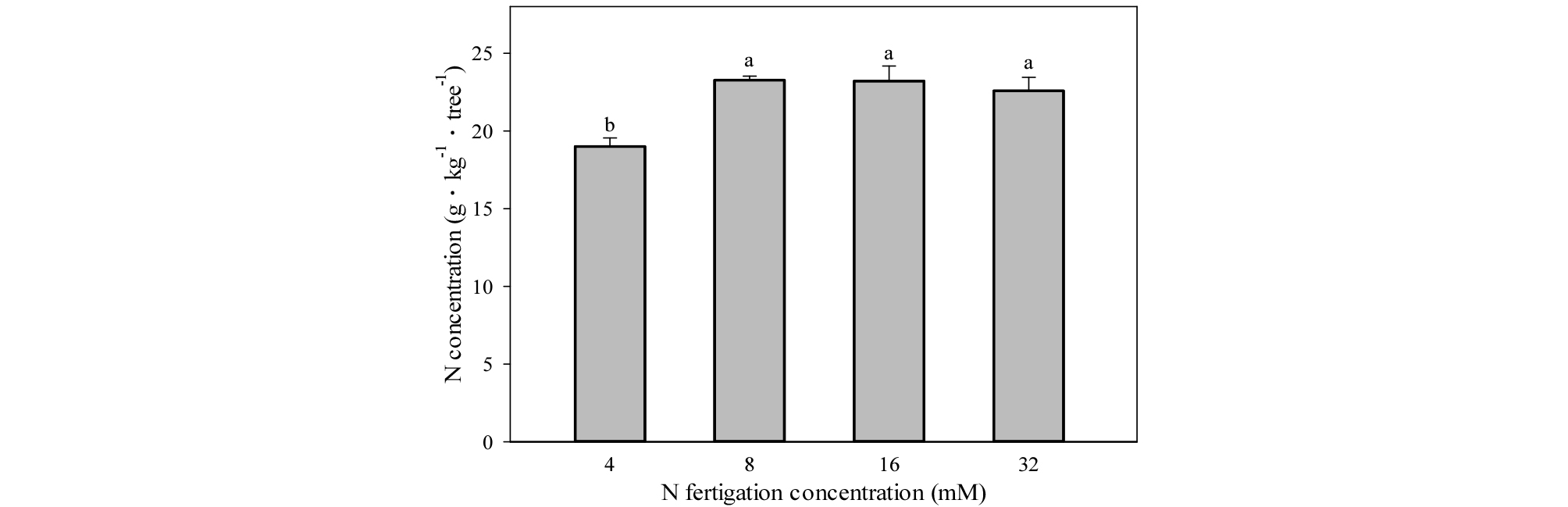
Fig. 7.
Nitrogen concentration in leaves in one-year-old ‘Fuji’/ M.9 apple potted trees under four different concentrations of nitrogen fertilization in 2015. The leaves were sampled on October 19, 2015. Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
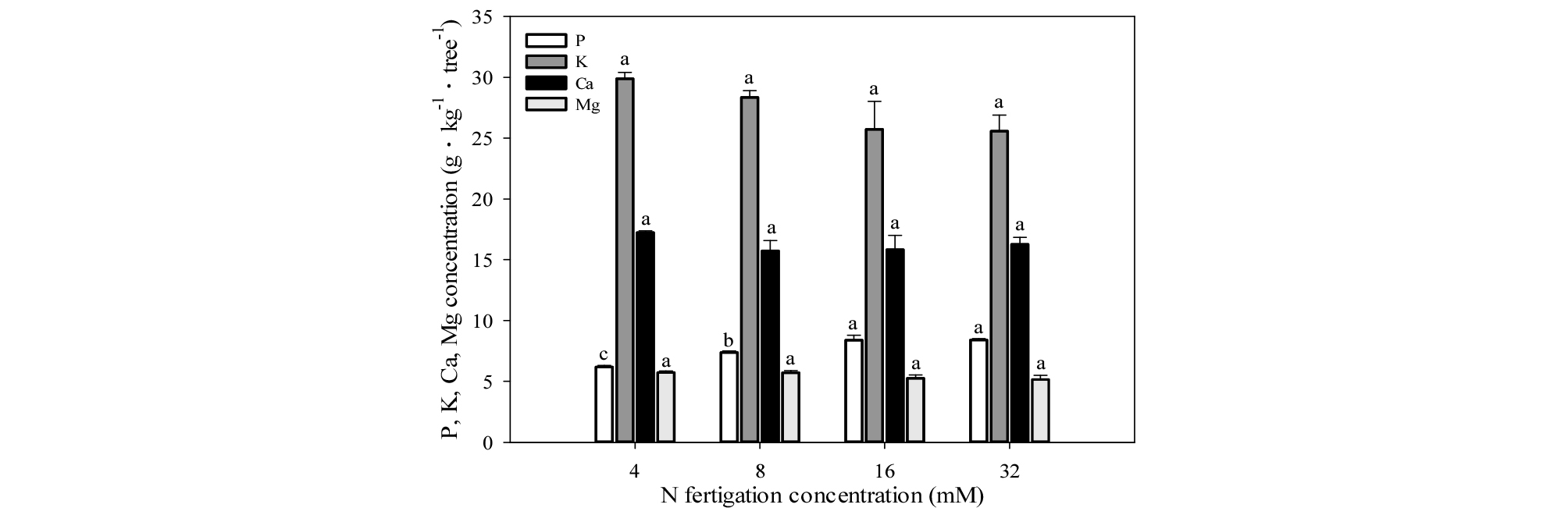
Fig. 8.
Phosphorus, potassium, calcium and magnesium concentrations in leaves of one-year-old ‘Fuji’/M.9 apple potted trees under four different concentrations of nitrogen fertilization in 2015. The leaves were sampled on October 19, 2015. Vertical bars represent mean ± SE (n = 3). Different letters indicate significant differences between the treatments (p < 0.05).
질소시비농도에 따른 토양 성분 분석
토양 pH는 질소시비농도가 높을수록 낮아져 4, 8 mM 처리구에서 각각 pH 6.6, 6.5로 높았고, 16 mM 이상 처리구에서 pH 6.3으로 낮았다. 유기물 함량은 모든 처리구에서 유의적 차이가 없었다. 전질소 함량은 4, 8 mM 처리구에서 0.56, 0.58 g・㎏-1으로 가장 높았으며, 16 mM은 0.46 g・㎏-1으로 중간이었으며, 32 mM에서 0.33 g・㎏-1으로 가장 낮았다. 유효인산은 모든 처리구에서 유의적 차이가 없었다. 치환성 칼리는 4 mM 처리구에서 0.7 cmol・㎏-1으로 가장 높았으며, 다른 처리구에서는 유의적 차이가 없었다. 칼슘은 질소시비농도가 높을수록 높아져 32 mM 처리구에서 10.3 cmol・㎏-1으로 가장 높았고, 16 mM은 8.8 cmol・㎏-1으로 중간이었으며, 4, 8 mM에서 각각 7.5, 7.7 cmol・㎏-1로 가장 낮았다. 마그네슘은 4 mM 처리구에서 2.7 cmol・㎏-1로 가장 높았으며, 8 mM에서 2.0 cmol・㎏-1, 16 mM에서 1.4 cmol・㎏-1, 32 mM에서 0.8 cmol・㎏-1로 질소시비농도가 높을수록 점차 낮아졌다.
고 찰
질소시비농도에 따른 수체 생장
질소는 식물을 구성하는 무기영양원소 중 가장 많은 비율을 차지하여 수체 생장에 미치는 영향이 매우 크다(Coruzzi and Last, 2000; Crawford et al., 2000). Gojon et al. (1991)은 질소시비농도가 높아지면서 잎과 줄기에서 질산의 환원과 질산환원효소활성이 증가되어 수체 생장이 많아졌다고 하였으나 Sonneveld and Voogt (2009)는 적정수준 이상의 질소시비는 오히려 수체의 생장을 감소시켰다고 하였다. 본 실험 결과 질소시비농도가 16 mM까지 높아질수록 포트묘목의 수고, 간주직경, 측지, 엽, 수체 건물중 등의 생장은 증가되었으나 32 mM 이상의 고농도에서는 생장이 부진한 것을 확인하였다. Hague and Neilsen (1991)은 ‘갈라’/O.3 사과에서 질소시비농도의 증가는 수체의 생장을 증가시켰다고 하였다. 반면 Kim et al. (2006)은 ‘신고’ 배에서 질소 200 ㎎・L-1까지 시비량이 증가할수록 수체 생장은 높아졌으나 질소 400 ㎎・L-1 이상의 시비량에서는 생장이 부진하였고, Salifu and Jacobs (2006)는 검은 호두나무에서 고농도의 질소시비 처리로 생장이 부진해지는 결과를 확인하였다. 이러한 생장 부진은 질소가 인과 아연처럼 길항관계에 있는 다른 무기영양원소의 흡수에 영향을 미치기 때문으로(Stiles and Reid, 1914), 본 실험에서 질소시비농도가 높아질수록 인의 농도는 높아지고(Fig. 8), 아연의 농도는 낮아져 질소 32 mM 처리구에서 Stiles and Reid (1914)가 제시한 적정수준보다 낮아진 것을 확인하였다. 따라서 적정 수준의 질소시비농도는 수체 생장을 늘리나 고농도의 질소시비는 수체 생장에 부정적인 영향을 미치는 것으로 생각된다.
무기영양원소는 뿌리생장에 영향을 미치며(Blazich, 1988), 낮은 농도의 다량무기원소가 뿌리생장에 유리하다(Nemeth, 1986). 본 실험 결과 근장과 근중은 질소시비농도가 가장 낮은 4 mM 처리구에서 높았으나 근수는 16 mM 처리구에서 많았다(Table 2). Moe and Andersen (1988)은 질소함량과 근수 및 근중의 부의 상관관계를 확인하였으나 Sriskandarajah et al., (1990)는 질소시비가 사과의 뿌리생장에 미치는 영향은 품종마다 다르다고 하였다. 따라서 뿌리생장에는 질소시비농도가 낮을수록 유리하나 질소시비에 따른 뿌리생장 특성은 사과 품종마다 다를 것으로 판단된다.
우리나라의 우량묘목 기준은 수고 140 ㎝ 이상, 접목부 상단 10 ㎝ 부위의 간주직경 12 ㎜ 이상, 길이 15 ㎝ 이상의 측지 5개 이상으로 종자산업법에 명시하고 있다(MAFRA, 2016). 본 실험 결과 1, 2년차 모든 처리구에서 수고와 간주직경에서 우량묘목 기준 이상의 생장을 보였으며(Figs. 1, 2), 우량묘목 기준 이상의 측지생장을 보인 처리구는 2년차의 16, 32 mM 처리구였다(Fig. 4). 따라서 16 mM 처리가 우량묘목 생산을 위한 적정 질소시비농도로 판단된다. 한편, 측지발생은 옥신과 사이토키닌의 상호작용에 의한 것이며(Sachs and Thimann, 1967), Barlow and Hancock (1962)은 적심으로 옥신 농도를 낮춰 측지발생을 유도하였고, Quinlan (1976)은 사과나무에서 benzyl adenine (BA) 엽면살포로 측지발생을 향상시켰다. 따라서 4, 8 mM 질소시비에 적심 또는 BA 처리는 측지수를 증가시켜 우량묘목 기준 이상의 생장을 할 것으로 기대되나, 이에 대한 추가 연구가 필요하다.
질소시비농도에 따른 엽 토양성분분석
본 실험에서 잎의 무기영양성분은 질소시비농도가 높아지면서 질소와 인의 농도는 높아졌으나 칼리, 마그네슘, 칼슘 농도는 차이가 없었다(Figs. 7, 8). 검은 호두나무 잎의 질소와 인 농도는 무처리구에 비해 질소처리구가 높았으나 처리구별 유의적 차이가 없었으며(Salifu and Jacobs, 2006), ‘후지’/M.26 사과에서 질소시비량에 따른 잎의 칼리, 칼슘, 마그네슘 농도는 유의적 차이를 보이지 않았다(Park, 1999)는 보고와 같이 질소시비농도는 잎의 무기영양원소에 영향을 미치지 않는 것으로 판단된다. 한편 본 실험의 수체 생장조사에서 질소시비농도 16 mM 처리구에서 우량묘목 생산이 가능하였으며, 이를 기준으로 포트묘목 잎의 무기성분 함량 적정치를 판단하면 질소, 인, 칼리, 칼슘, 마그네슘의 함량은 각각 23.0±2.0, 8.6±0.6, 25.2±4.2, 13.6±2.6, 5.4±0.4 g・㎏-1・tree-1이라고 할 수 있을 것이다. 이러한 잎의 무기성분 함량은 Lee et al. (2002)가 제시한 재식 2년차 ‘후지’/M.9 사과 잎의 적정 무기영양성분 함량보다 높았다. Idris et al. (2004)은 검은 가문비나무에서 묘목의 높은 무기영양성분은 정식 후 수체 생장을 증가시켰다고 하였다. 따라서 본 실험에서 생산된 포트 우량묘목의 높은 무기영양성분은 정식 후 수체 생장에 도움될 것으로 생각되나, 이에 대한 추가적인 연구가 필요하다.
본 실험 결과 질소시비농도가 증가할수록 토양의 pH, 치환성 칼리와 마그네슘은 낮아졌으나 전질소와 유효인산은 처리구별 차이가 없었다(Table 3). 질소는 토양에서 질산화 작용에 의해 수소이온이 용출되어 칼리, 칼슘, 마그네슘 이온과 길항작용을 일으킨다(Rowell, 1994). Belton and Goh (1992)는 질소시비량이 증가할수록 토양의 pH, 치환성 칼리, 칼슘, 마그네슘이 낮아졌으며, Peng et al. (2008)은 질소시비량에 따른 사과원 토양의 전질소와 유효인산 함량의 유의적 차이는 없었음을 보고했다. 따라서 질소시비농도는 토양의 화학성에 영향을 미치는 것으로 판단되며, 본 실험의 8, 16 mM 처리구가 사과원 토양 화학성의 적정범위를 유지하여 안정적이었다(RDA, 2013). 하지만 실제적인 농가 적용에 있어 적심, BA 처리 및 포트용적 등에 따라 우량묘목 생산을 위한 질소시비농도는 달라질 수 있으며, 이에 대한 추가적인 연구가 필요하다.
Table 3. Soil chemical properties in four different concentrations of nitrogen-treated pots
적 요
사과 ‘후지’/M.9 포트묘목 개발을 위해 질소시비농도에 따른 생장특성을 조사하고, 포트 우량묘목 생산에 적합한 질소시비농도와 잎의 무기영양성분 함량 및 토양 화학성의 안정성을 확인하였다. 질소시비농도가 높아질수록 묘목의 생장은 증가되었고, 특히 16 mM 처리가 수체 생장에 가장 좋았으며, 우량묘목 판단기준에 부합하였다. 32 mM 이상의 고농도는 오히려 생장을 감소시켰다. 잎의 무기영양성분 함량은 8, 16 mM 처리구에서 기존 사과과원의 적정수준보다 높았고, 이러한 무기영양성분은 정식 후 수체 생장에 도움이 될 것으로 생각되었다. 토양 화학성 또한 8, 16 mM 처리구에서 안정적이었다. 따라서 수체 생육, 잎의 무기영양성분, 포트 내 토양화학성을 고려한 결과, 사과 ‘후지’/M.9 우량 포트묘목 생산을 위한 적정 질소시비량은 16 mM로 판단되었다.