서 언
재료 및 방법
공시재료 및 추출 방법
LC-ESI-MS 분석
HPLC-PDA 분석
총 폴리페놀 함량 측정
총 플라보노이드 함량 측정
DPPH radical 소거활성 측정
ABTS radical 소거활성 측정
통계처리
결과 및 고찰
LC-ESI-MS 분석
HPLC-PDA 분석
추출용매에 따른 꼬리진달래 추출물의 폴리페놀 및 플라보노이드 함량 분석
추출용매에 따른 꼬리진달래 추출물의 항산화 활성 분석
적 요
서 언
인구의 고령화와 삶의 질 향상으로 건강에 관한 관심이 높아짐에 따라 기능성 식품과 의약품의 수요가 증가하고 있으며, 그로 인해 자원식물은 바이오산업 소재로 재평가되고 있다(Song et al., 2020). 인간의 생활에 유용하게 사용되는 식물인 자원식물은 정확한 용도와 이용법이 밝혀져 있지 않은 종이 많아 잠재적인 이용가능성이 높다(Kang, 2008).
꼬리진달래(Rhododendron micranthum)는 충청북도, 경상북도, 강원도 지역에 자생하는 진달래과(Ericaceae) 진달래속(Rhododendron)에 속하는 상록활엽관목으로 산림청 지정 희귀식물이다(Korea national arboretum, 2021). 꼬리진달래의 꽃은 조산백(照山白)이라 하여 기관지염, 이질, 산후 신체의 동통, 골절을 치료하는 용도로 약용한다고 알려져 있으며(Kim et al., 2018), 발효추출물은 미백효과와 항주름효과가 있어 자원화 가능성이 있는 수종으로 알려져 있다(Oh et al., 2018). 또한 꼬리진달래가 속하는 진달래속의 식물들은 식품 첨가물이나 의약품의 원료로 많이 이용되고 있다(Grimbs et al., 2017).
폴리페놀 화합물은 식물의 대표적인 생리활성 물질로 페놀산류, 플라보노이드류, 스틸벤류, 쿠마린류, 리그닌류, 탄닌류 등으로 분류되며, 그 구조의 페놀성 OH기가 항산화 활성의 근원으로 알려져 있다(Shahidi and Yeo, 2018). 폴리페놀 화합물은 항산화 효과 및 항암, 항염 효과가 우수하고 인공 화합물에 비해 적은 부작용을 가져 대체 원료 물질로 주목받고 있으며(Cha et al., 1999; Tapsell et al., 2006), 자원식물을 대상으로 이와 관련된 연구들이 수행되고 있다(Kim et al., 2010; Lee et al., 2005b). 따라서 자원식물 개발을 위해 폴리페놀 화합물의 구성과 함량을 분석하는 것이 필요하다(Kim and Kim, 2007).
국내 자생하는 진달래속의 폴리페놀 화합물에 관한 연구는 R. yedoense, R. barachycarpum, R. mucronulatum, R. schlippenbachii를 대상으로 수행되었으나(Jung et al., 2007; Kim et al., 2006; Lee et al., 2005a; Youn and Cho, 1991), 꼬리진달래의 폴리페놀 화합물에 관한 연구는 미흡한 실정이다. 따라서 본 연구는 꼬리진달래의 폴리페놀 프로파일링을 통해 유용성이 높은 물질을 선발하고 추출용매에 따른 유용성분의 함량과 항산화 활성을 비교하여 천연물 원료로서의 활용 가능성에 대한 정보를 제공하고자 하였다.
재료 및 방법
공시재료 및 추출 방법
본 연구에서 사용된 꼬리진달래는 2023년 7월에 충북 괴산 조령산 지역에서 신초 부위를 채취하였다(36°48'58.4"N, 128°02'48.1"E). 채취한 시료는 수세하여 이물질을 제거하고 동결건조(FD5508, Ilshin BioBase, Yangju, Korea) 후 분쇄하여 실험에 이용할 때까지 –80℃에서 보관하였다.
저장된 꼬리진달래 시료는 1:100 (w/v) 비율로 80% 메탄올, 80% 에탄올, 증류수를 첨가하여 60℃에서 1시간 동안 초음파 추출(UCP-10, JEIO TECH, Daejeon, Korea)하였다. 추출물은 20분간 4,000 rpm으로 원심분리하고 상등액을 4℃로 보관하면서 실험에 사용하였다.
LC-ESI-MS 분석
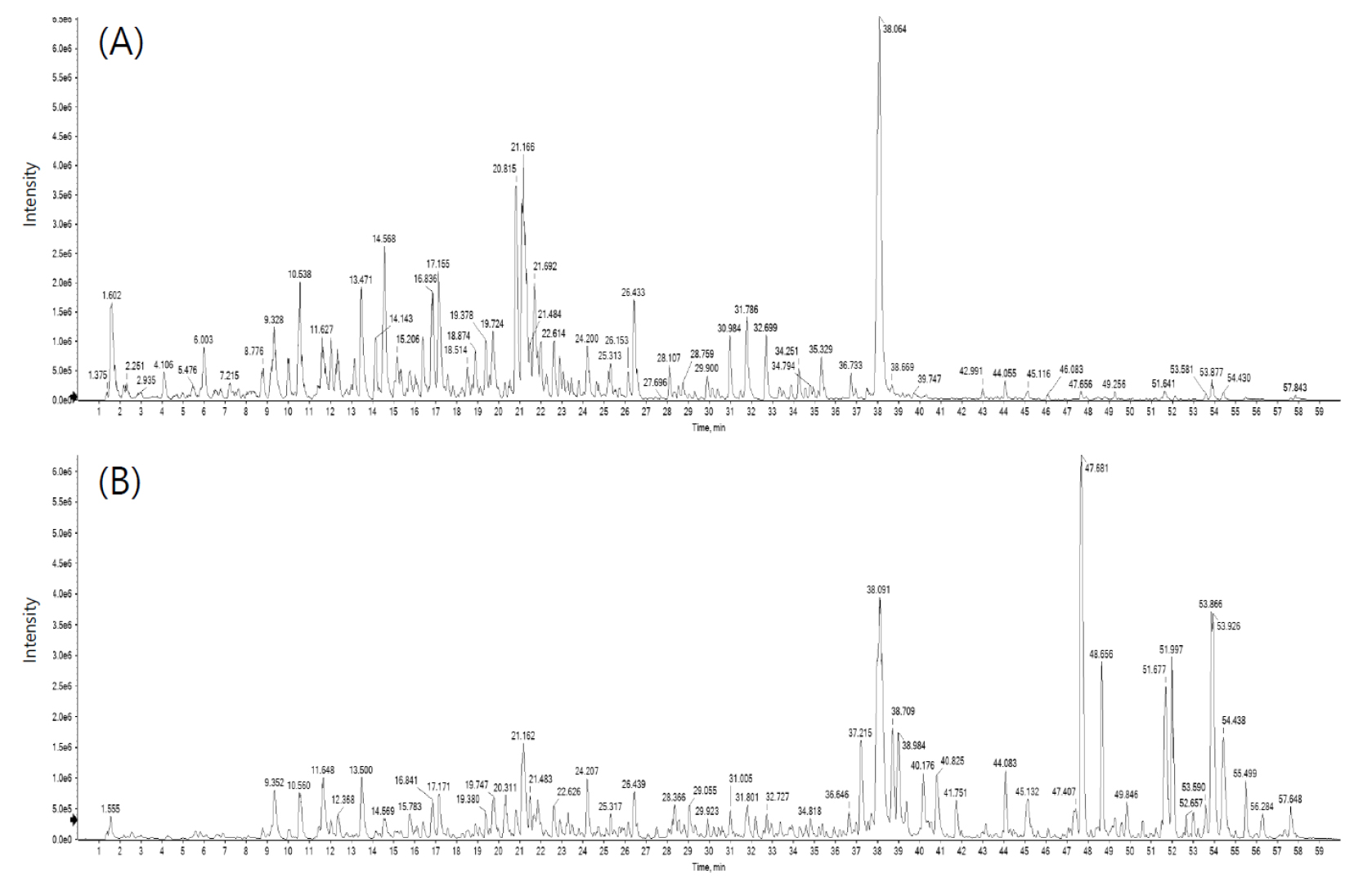
분자량 분포에 따른 폴리페놀 화합물 탐색을 위해 꼬리진달래 메탄올 추출물을 0.45 ㎛ syringe filter (HENKE-JECT, Tuttlingen, Germany)로 여과하여 분석에 사용하였다. 정성분석은 Triple TOF 5600+ (AB Sciex company, Concord, ON, Canada)와 Waters Cortex C18 column (150 × 2.1 ㎜, 1.6 ㎛, Waters Corp., Milford, MA, USA)이 장착된 Thermo Ultimate 3000 (Thermo Scientific, MA, USA)을 사용하였다. 컬럼온도는 45℃, 유속은 0.25 mL/min, 시료 주입량은 10 μL로 하여 검출파장 254 ㎚에서 분석하였으며, 분석조건은 Table 1과 같다.
Table 1.
MS information for R. micranthum ESI-MS analysis.
HPLC-PDA 분석
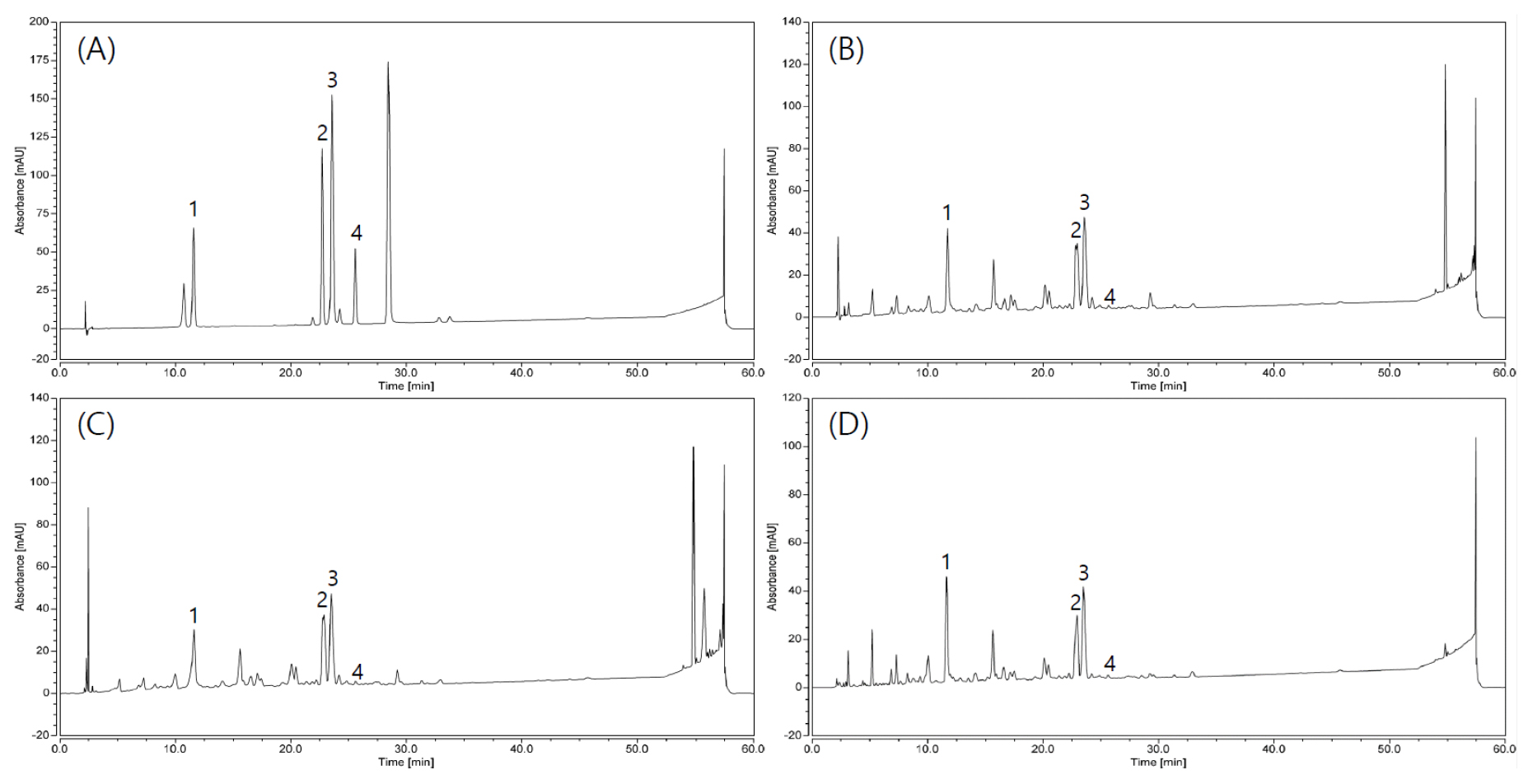
추출용매에 따른 chlorogenic acid, astragalin, myricetin, afzelin 함량을 측정하기 위해 꼬리진달래 추출물과 메탄올에 용해한 표준물질을 0.45 ㎛ syringe filter로 여과하여 분석에 사용하였다. Thermo Ultimate 3000 (Thermo scientific, MA, USA)과 Hypersil GOLD C18 (250 × 4.6 ㎜, 5 ㎛, Thermo scientific, MA, USA)을 이용하여 컬럼온도 45℃, 유속은 1.5 mL/min, 시료 주입량은 10 μL로 하여 검출파장 254 ㎚에서 분석하였으며, 분석조건은 Table 2와 같다. 모든 용매는 사용 전 탈기 및 여과하였다. 시료의 검출시간(retention time, RT)을 표준물질의 스펙트럼과 비교하여 정성 평가를 수행하였으며 꼬리진달래 추출물의 피크 면적을 기준으로 표준물질의 검량선을 이용하여 정량 분석하였다.
Table 2.
HPLC condition for chlorogenic acid, astragalin, myricetin, afzelin analysis.
총 폴리페놀 함량 측정
총 폴리페놀 함량은 Kim et al. (2022)의 방법을 변형하여 측정하였다. 1 ㎎/mL 농도의 꼬리진달래 추출물 100 μL에 0.2 N Folin-Ciocalteu 시약 2.5 mL를 혼합하여 상온에서 5분간 반응시킨 후 20% sodium carbonate 500 μL를 넣고, 상온에서 30분간 반응시켜 분광광도계(SpectraMax iD3, Molecular Devices, Inc., Sunnyvale, CA, USA)를 이용하여 760 ㎚ 파장에서 흡광도를 측정하였다. 표준물질로 gallic acid를 사용하여 표준곡선을 계산하였으며, 총 폴리페놀 함량은 시료 g당 mg gallic acid equivalent (GAE)로 표시하였다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Lee et al. (2022)의 방법을 변형하여 측정하였다. 1 ㎎/mL 농도의 꼬리진달래 추출물 100 μL에 5% sodium nitrite 30 μL와 증류수 500 μL를 넣고 상온에서 6분간 반응시킨 후, 10% aluminium chloride 60 μL를 넣고 상온에서 5분간 반응시켰다. 그 후, 1M sodium hydroxide 200 μL와 증류수 100 μL를 넣고 10분간 반응시킨 후 분광광도계를 이용하여 415 ㎚ 파장에서 흡광도를 측정하였다. 표준물질로 quercetin을 사용하여 표준곡선을 계산하였으며, 총 플라보노이드 함량은 시료 g당 mg quercetin equivalent (QE)로 표시하였다.
DPPH radical 소거활성 측정
추출용매에 따른 꼬리진달래 추출물의 DPPH radical 소거활성은 Lee et al. (2023a)의 방법을 변형하여 측정하였다. 농도별 꼬리진달래 추출물 50 μL에 0.2 mM DPPH 시약 1 mL를 첨가하여 상온에서 20분간 반응시키고 분광광도계를 이용하여 517 ㎚ 파장에서 흡광도를 측정하여 radical 감소를 정량하였다. 꼬리진달래 추출물의 DPPH radical 소거활성은 아래의 식을 이용하여 계산하였으며, DPPH radical을 50% 소거하는 농도(IC50)를 계산하였다. 대조군으로 L-ascorbic acid를 사용하였다.
DPPH radical 소거활성(%) : (1 – A/B) × 100
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
ABTS radical 소거활성 측정
추출용매에 따른 꼬리진달래 추출물의 ABTS radical 소거활성은 Lee et al. (2023b)의 방법을 변형하여 측정하였다. ABTS 시약은 7 mM ABTS와 2.45 mM potassium persulfate를 혼합한 후 암소 상온에서 24시간 반응시킨 후 증류수를 이용하여 732 ㎚ 파장에서 흡광도가 0.7±0.03이 되도록 희석하여 제조하였다. 꼬리진달래 추출물 50 μL에 ABTS 시약 950 μL를 혼합하여 암소 상온에서 20분간 반응시킨 후 분광광도계를 이용하여 732 ㎚ 파장에서 흡광도를 측정하여 radical 감소를 정량하였다. 꼬리진달래 추출물의 ABTS radical 소거활성은 아래의 식을 이용하여 계산하였으며, ABTS radical을 50% 소거하는 농도(IC50)를 계산하였다. 대조군으로 L-ascorbic acid를 사용하였다.
ABTS radical 소거활성(%) : (1 – A/B) × 100
A : 시료 첨가구의 흡광도
B : 시료 무첨가구의 흡광도
통계처리
모든 실험은 3회 이상 반복 실험하여 수집된 데이터를 평균과 표준편차로 나타냈다. 통계처리는 R program (Ver 4.2.2)을 이용하여 평균 간 유의차를 95% 수준에서 일원분산분석(One-way ANOVA)을 실시하고, Duncan’s multiple range test로 유의적 차이를 검정하였다.
결과 및 고찰
LC-ESI-MS 분석
LC-ESI-MS 분석을 통해 꼬리진달래 추출물의 폴리페놀을 프로파일링하여 chlorogenic acid (m/z 354.1), hyperoside (m/z 464.1), astragalin (m/z 448.1), myricetin (m/z 318.0), afzelin (m/z 432.1), quercetin (m/z 302.0) 등 37개의 폴리페놀 화합물을 확인하였다(Fig. 1, Table 3). 폴리페놀 프로파일링 결과 함량이 높고 기존 진달래속에서 유용물질로 보고되었던(Dai et al., 2021; Gautam et al., 2020; Łyko et al., 2022) chlorogenic acid, astragalin, myricetin, afzelin을 주요 유용성분으로 선발하였다(Fig. 2).
Chlorogenic acid은 항균 활성이 있으며(Lou et al., 2011), 당뇨, 비만, 알츠하이머와 뇌졸중 치료에 효과가 있고(Eskelinen and Kivipelto, 2010; Lopez-Garcia et al., 2009; Thom, 2007; Van Dam and Hu, 2005), astragalin은 항산화(Bitis et al., 2010), 항염증(Kim et al., 2017), 항암(Burmistrova et al., 2011)의 다양한 약리학적 특성을 가지며, myricetin은 항산화제, 항균제, 항바이러스제, 항당뇨제, 항암제, 항염증제 및 항궤양제 등의 효능이 있다(Gupta et al., 2020). Afzelin은 신장염을 개선하며, 항산화 및 항염증 활성을 가진다고 보고되고 있다(Wang et al., 2022).
Table 3.
LC-ESI-MS profiling of R. micranthum in positive and negative ionization modes.
|
Retention time (min) |
Molecular weight | Proposed structure |
| 4.09 | 300.1 | Benzoic acid + 1O, O-Hexy |
| 5.63 | 306.1 | Epigallocatechinz |
| 7.23 | 354.1 | Neochlorogenic acidy |
| 8.72 | 340.1 | Daphnetin-8-glucosidey |
| 9.33 | 306.1 | Gallocatechinzy |
| 10.04 | 290.1 | Catechinzy |
| 10.55 | 354.1 | Chlorogenic acidzy |
| 10.56 | 180.0 | Caffeatez |
| 10.71 | 326.1 | Coumaric acid O-glucosidey |
| 12.34 | 578.1 | Procyanidin B2zy |
| 12.68 | 370.1 | Fraxiny |
| 12.77 | 320.1 | Dihydromyricetiny |
| 15.05 | 480.1 | Myricetin 3-galactosidey |
| 15.35 | 866.2 | Procyanidin C1zy |
| 17.14 | 412.2 | Grayanotoxin Izy |
| 17.19 | 480.1 | Gossypinzy |
| 17.20 | 464.1 | Spiraeosidezy |
| 18.88 | 450.1 | Myricetin-3-O-xylosidey |
| 19.37 | 464.1 | Hirsutrinzy |
| 19.73 | 464.1 | Hyperosidezy |
| 19.78 | 576.1 | Procyanidin A1z |
| 20.52 | 434.1 | Guaiaveriny |
| 20.87 | 434.1 | Aviculariny |
| 21.07 | 448.1 | Astragalinzy |
| 21.25 | 448.1 | Trifoliny |
| 21.70 | 318.0 | Myricetinzy |
| 22.63 | 432.1 | Afzeliny |
| 23.27 | 446.1 | Sissotrinzy |
| 23.46 | 288.1 | maesopsiny |
| 24.25 | 302.0 | Quercetinzy |
| 24.52 | 178.1 | p-MeOCinnamicAcidz |
| 26.44 | 286.0 | Kaempferolzy |
| 29.91 | 300.1 | Farrerolzy |
| 33.89 | 298.1 | Afrormosiny |
| 34.81 | 314.1 | 4-Hydroxy-2',4',6'-trimethoxychalconezy |
| 38.90 | 312.1 | 5,7,3'-Trimethoxyflavonez |
| 40.04 | 328.1 | 2',4,4',6'-Tetramethoxychalconez |
HPLC-PDA 분석
꼬리진달래의 주요 유용성분으로 선발된 chlorogenic acid, astragalin, myricetin, afzelin의 추출 용매별 함량을 비교한 결과, chlorogenic acid는 6.29 ~ 6.57±0.12 ㎎/g이었고 에탄올 추출물에서 함량이 가장 높게 나왔으나 추출용매에 따른 차이는 통계적으로 유의미하지 않았다. Astragalin은 에탄올 추출물에서 함량이 2.29±0.02 ㎎/g으로 가장 높았으며, 열수 추출물에서 1.35±0.02 ㎎/g으로 가장 낮았다. Myricetin은 메탄올, 에탄올 추출물에서 각각 4.77±0.06 ㎎/g, 4.52±0.27 ㎎/g로 열수 추출물보다 높았다. Afzelin은 메탄올 추출물의 함량이 0.10±0.01 ㎎/g으로 가장 높았으나 추출용매에 따른 차이는 통계적으로 유의미하지 않았다(Fig. 3, Table 4).
이전 연구에서는 동일 속인 R. arboreum 잎의 chlorogenic acid 함량이 4.01 ㎎/g (Gautam et al., 2020), R. przewalskii 잎의 astragalin 함량이 0.08 ㎎/g으로 보고되었다(Dai et al., 2021). 또한 R. luteum 잎의 myricetin 함량이 1.37 ㎎/g, afzelin 함량이 0.018 ㎎/g (Łyko et al., 2022)으로 보고되어 꼬리진달래의 chlorogenic acid, astragalin, myricetin, afzelin 함량이 동일 속의 다른 종보다 높은 것으로 판단되었다.
Table 4.
Chlorogenic acid, astragalin, myricetin and afzelin contents of R. micranthum depending on the extraction solvents.
| Solvent | Contents (㎎/g) | |||
| Chlorogenic acid | Astragalin | Myricetin | Afzelin | |
| Methanol | 6.44±0.38 | 2.03±0.08bz | 4.77±0.06a | 0.10±0.01 |
| Ethanol | 6.57±0.12 | 2.29±0.02a | 4.52±0.27a | 0.08±0.03 |
| Water | 6.29±0.00 | 1.35±0.02c | 4.05±0.00b | 0.09±0.00 |
추출용매에 따른 꼬리진달래 추출물의 폴리페놀 및 플라보노이드 함량 분석
꼬리진달래의 총 폴리페놀 함량은 에탄올 추출물에서 80.01±2.36 ㎎/g으로 가장 높았으며, 열수 추출물에서 56.31±1.81 ㎎/g으로 가장 낮았다. 또한 총 플라보노이드 함량은 에탄올 추출물에서 78.08±3.44 ㎎/g으로 가장 높았으며, 열수 추출물에서 49.82±3.41 ㎎/g으로 가장 낮아 총 폴리페놀 함량과 유사한 경향을 보였다(Table 5). 이는 일반적으로 식물을 이용한 추출 시 유기용매 추출이 열수 추출에 비해 총 폴리페놀 함량과 총 플라보노이드 함량이 높다는 보고와 유사하였다(Sultana et al., 2009). 또한 동일 속의 종들과 비교하여 꼬리진달래의 총 폴리페놀 함량은 R. anthopogon의 44.53 ㎎/g 보다 높았고(Rathore et al., 2018), 총 플라보노이드 함량은 R. weyrichii의 16.7 ㎎/g 보다 높아(Kim et al., 2019), 꼬리진달래의 자원화 가능성을 확인하였다.
Table 5.
Total polyphenol and flavonoid contents of R. micranthum depending on the extraction solvents.
| Solvent | TPC (㎎GAE/g) | TFC (㎎QE/g) |
| Methanol | 74.64±4.39az | 66.10±1.67b |
| Ethanol | 80.01±2.36a | 78.08±3.44a |
| Water | 56.31±1.81b | 49.82±3.41c |
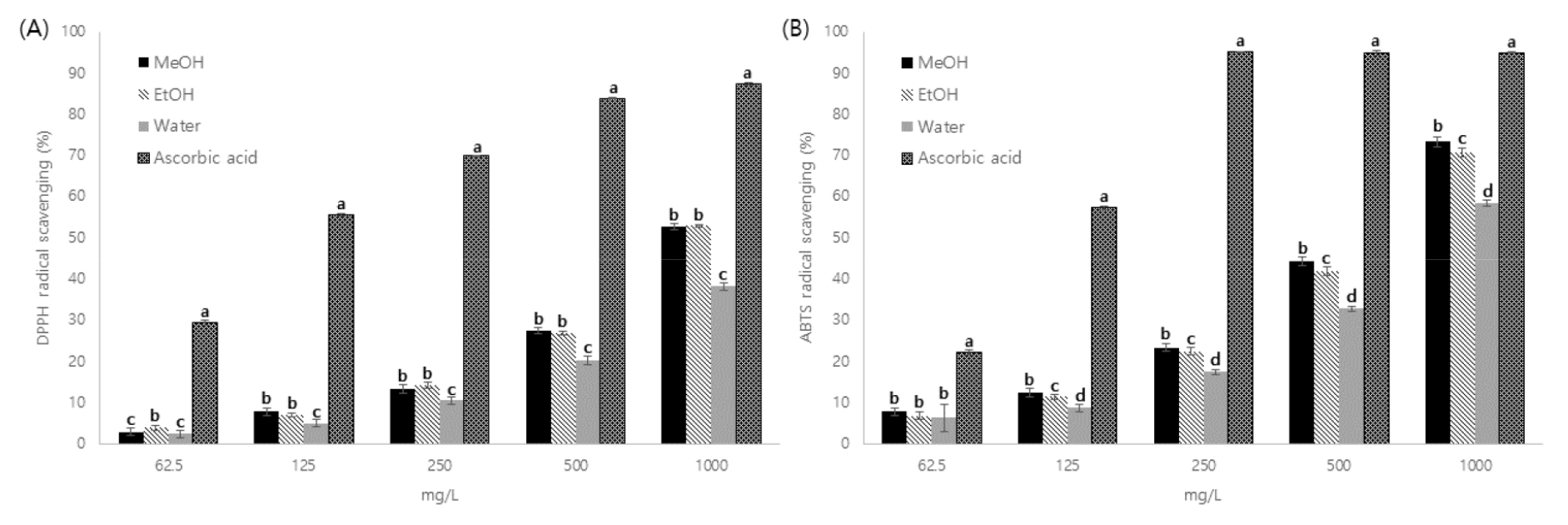
추출용매에 따른 꼬리진달래 추출물의 항산화 활성 분석
추출용매에 따른 꼬리진달래 추출물의 항산화 활성을 확인하기 위해 DPPH, ABTS radical 소거활성을 측정하였으며 농도 의존적으로 항산화 활성이 증가하는 것을 확인하였다(Fig. 4). 꼬리진달래의 DPPH radical 소거활성의 IC50값은 메탄올 추출물에서 943.57±10.68 ㎎/L로 가장 낮았으며, 열수 추출물에서 1,329.58±16.04 ㎎/L로 가장 높았다(Table 6). 동일 속인 R. brachycarpum 잎의 에탄올 추출물의 IC50값은 2,648.13 ㎎/L로 꼬리진달래 추출물보다 높았으나(Choi and Rhim, 2011) R. anthopogonoides 에탄올 추출물의 IC50값은 621.03 ㎎/L로 꼬리진달래의 추출물보다 낮았다(Jing et al., 2015).
ABTS radical 소거활성의 IC50값은 메탄올 추출물에서 641.60±7.58 ㎎/L로 가장 낮았으며, 열수 추출물에서 837.73±2.77 ㎎/L로 가장 높아 DPPH radical 소거활성과 유사한 경향을 보였다(Table 6). R. anthopogonoides 에탄올 추출물의 IC50값은 536.39 ㎎/L로 꼬리진달래 추출물보다 낮았다(Jing et al., 2015). DPPH는 free radical을 제거하는 방법이고, ABTS는 positive ion radical을 제거하는 방법이기 때문에 radical에 결합하여 제거하는 정도가 달라 radical 소거활성에 차이가 발생할 수 있다(Meir et al., 1995). 또한 유기용매 추출물의 항산화 활성이 열수 추출물보다 높은 것은 유기용매 추출물의 총 폴리페놀 함량이 열수 추출물보다 높은 영향으로 생각되며, 이러한 경향은 폴리페놀 함량이 항산화 활성과 상관관계가 있다는 보고와 유사하였다(Arnous et al., 2001).
이러한 결과를 종합하여 볼 때, 꼬리진달래는 자원화 가능성을 가지고 있으며, 건강기능성 소재로의 개발을 위해 추후 세포 및 동물 실험을 통한 추가적인 검증이 필요할 것으로 판단된다.
Table 6.
DPPH, ABTS IC50 values of R. micranthum depending on the extraction solvents.
| Solvent | DPPH (IC50, ㎎/L) | ABTS (IC50, ㎎/L) |
| Methanol | 943.57±10.68bz | 641.60±7.58c |
| Ethanol | 944.25±4.37b | 671.23±6.82b |
| Water | 1,329.58±16.04a | 837.73±2.77a |
적 요
본 연구는 꼬리진달래의 자원식물 개발을 위한 정보를 제공하고자 수행되었다. 꼬리진달래 신초 추출물의 폴리페놀 프로파일링을 통해 유용성분을 선발하고, 추출용매에 따른 유용성분 함량과 항산화 활성을 비교하였다. 꼬리진달래 신초 추출물에서 37개의 폴리페놀 화합물을 확인하였으며, chlorogenic acid, astragalin, myricetin, afzelin의 추출용매별 함량을 비교한 결과, chlorogenic acid의 함량은 에탄올 추출물에서 6.57±0.12 ㎎/g이었고, astragalin의 함량은 에탄올 추출물에서 2.29±0.02 ㎎/g, myricetin의 함량은 메탄올 추출물에서 4.77±0.06 ㎎/g, afzelin의 함량은 메탄올 추출물에서 0.10±0.01 ㎎/g이었다. 꼬리진달래 에탄올 추출물의 총 폴리페놀 함량은 80.01±2.36 ㎎/g, 총 플라보노이드 함량은 78.08±3.44 ㎎/g이었다. 또한 꼬리진달래 메탄올 추출물의 DPPH radical 소거활성 IC50값은 943.57±10.68 ㎎/L였으며, ABTS radical 소거활성 IC50은 641.60±7.58 ㎎/L였다. 꼬리진달래는 유기용매 추출 시 유용성분과 항산화 활성이 높았고, 동일 속의 종들과 비교하여 높은 함량의 chlorogenic acid, astragalin, myricetin, afzelin을 함유하고 있어 향후 건강기능성 소재로의 개발이 가능할 것으로 판단된다.