서 언
재료 및 방법
실험재료
추출물 제조
세포 생육 억제활성 측정
SDS-PAGE 및 Western blot 분석
통계분석
결과 및 고찰
STB의 HCT116세포에 대한 apoptosis유도를 통한 세포생육 억제활성
HCT116세포에서 STB의 P65 핵내 전이를 통한 NF-κB 신호전달 활성화
STB-E100의 IκB-α의 인산화를 통한 단백질 분해 유도활성
HCT116세포에서 STB-E100의 GSK3β 의존성 P65 핵내 전이 유도활성
STB-E100의 HCT11세포에서 GSK3β 활성화 유도활성
적 요
서 언
암은 전세계적으로 생명을 위협하는 질병이며, 증가하고 있는 인류의 기대수명에 큰 장애물로 여겨지고 있다(Bray et al., 2018; Jung et al., 2018). 그 중 대장암은 세번째로 흔한 악성종양이면서 네번째 주요 사망원인으로 유전적, 환경적인 요소로 인해 높은 발병률과 사망률을 보이고 있으며, 2018년에는 약 180만건의 발병과 약 88만명이 사망하는 사례가 그 예이다(Arghiet al., 2019; Yaghoubi et al., 2019). 최근 대장암에 대한 Fluorouracil, Capecitabine, Cetuximab와 같은 항암제를 이용한 화학적 치료나 외과적 절제 수술이 효과적인 치료법으로 알려져 있다(Hassanzadeh, 2011; Meyerhardt and Mayer, 2005). 하지만 기존의 방사선이나 화학요법과 같은 항암치료법들은 변비, 골수 억제, 점막염, 구토, 구역, 탈모증, 우울증 및 피로와 같은 부작용을 유발할 수 있다(Irmak et al., 2019). 이에 대한 대안으로 식물에서 추출한 보완대체제의 사용이나 기존의 치료법에 한의학적 치료법을 응용한 치료기법이 증가하고 있다(Wang et al., 2012). 식물보완대체제의 예로 소엽맥문동(Ophiopogon japonicus), 노빌계(Dendrobium nobile), 만삼(Codonopsis pilosula), 현삼(Scrophularia ningpoensis) 그리고 단삼(Salvia miltiorrhiza) 등이 있다(Cheng et al., 2018). 그 외 많은 식물보완대체제 중 중국 자두로 알려져 있는 상동나무(Sageretia thea)는 갈매나무과(Rhamnaceae)의 상록수로 한국과 중국에서 전통한방의 약용식물로써 간염과 발열 치료제로 쓰여왔다(Hyun et al., 2015). 최근 상동나무의 기능성 연구에 따르면, 상동나무 가지와 잎 추출물은 NF-κB 신호전달과 MAPK 신호전달의 활성 억제와 HO-1 특정 단백질 발현 유도를 통하여 항염증 활성을 나타낸다고 보고되었다(Kim et al., 2019c). 또한 상동나무 가지와 잎 추출물의 HO-1 단백질 발현 유도와 세포생육 관련 단백질인 cyclin D1의 GSK3β 의존성 단백질 분해를 통해 인간 대장암 세포의 세포사멸을 유도한다고 보고되었으며(Kim et al., 2019b), 대장암 세포와 폐암 세포에 대해 Wnt/β-catenin 신호전달경로의 핵심단백질인 β-catenin의 분해 유도를 통해 세포 사멸을 유도한다고 보고되었다(Kim et al., 2019a). 대장암과 같은 암세포 생육 관련 신호전달경로와 항암 약물 개발을 위한 분자 메커니즘 구명은 암 연구에 있어 중요한 목표이며 관련 표적 탐색으로 환자의 예후를 연장시킬 수 있는 표적요법의 중요성이 대두되고 있다(Bi et al., 2006; Hassanzadeh, 2011). 메커니즘 중에서도 NF-κB 신호전달은 인간의 다양한 암들의 진행이나 발달에 관여한다고 알려져 있으며 암세포에서의 proapoptosis 및 antiapoptosis 조절에서 NF-κB 신호전달의 역할은 많은 연구의 대상이 되었다(Hassanzadeh, 2011; Bours et al., 2000). NF-κB 신호전달의 활성화가 apoptosis를 억제한다고 널리 알려져 있지만 일부 상황에서 Fas, Fas-ligand와 같은 apoptosis 유도 유전자 발현을 자극하여 apoptosis를 유도하는 역할을 한다고 보고되었다(Perkins and Gilmore, 2006). 그 예로 NF-κB 신호전달 활성화를 통한 항염증 활성을 가지는 NSAID 치료제가 암세포에 대한 세포생육 억제활성 또한 NF-κB 신호전달 활성화를 통해 유도한다고 보고된 바 있다(Jeong et al., 2013). 본 연구에서는 상동나무의 NF-κB 신호전달을 통한 인간 대장암 세포생육 억제활성에 대해 평가하기 위해 상동나무 가지 추출물의 대장암 세포에 대한 NF-κB 신호전달 조절 활성을 통한 세포생육 억제활성을 조사하였다.
재료 및 방법
실험재료
본 연구에서 대장암 세포 배양을 목적으로 사용된 배지인 Dulbecco’s modified Eagle’s medium (DMEM)/F-12 1 : 1 modified medium (DMEM/F-12)는 Lonza (Morristown, NJ, USA)에서 구매하였다. 단백질분해 억제제인 MG132, 특정 효소활성 억제제인 PD98059, SB203580, SP600125, LY294002, LiCl 및 BAY11-7082와 세포생육 억제효능을 평가하기 위한 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)는 Sigma-Aldrich (St. Louis, MO, USA)사에서 구매하였다. western blot 분석을 위해 사용된 항체인 Cleaved PARP, IκB-α, P65, GSK3β, phosph-GSK3β, TBP, actin은 Cell Signaling Technology (Danvers, MA, USA)에서 구매되었다.
추출물 제조
본 연구에서 사용된 시료인 상동나무 가지는 국립산림과학원 산림 약용 자원연구소로부터 제공받아 연구를 진행하였다. 상동나무의 확증표본(표본번호: FM.J.S. 20180510-01)은 국립산림과학원 산림 약용 자원연구소에 보관하고 있으며 이는 산림 약용 자원연구소의 손호준 박사의 식물학적 동정을 거쳤다. 상동나무 가지 20 g을 0, 10, 20, …, 100%의 ethanol 400 mL과 함께 7일 동안 추출한 후 원심분리하여 농도별 Ethanol 추출물을 회수하였다. 회수한 상동나무 가지 ethanol 추출물들은 감압 환류 냉각장치(N-1110S, EYElA, Tokyo, Japan)를 사용하여 40℃ 이하의 중탕에서 농축하여 동결건조 하였다. 건조된 Ethanol 추출물들은 -80℃의 냉동고에 보관하여 본 연구를 위한 시료로 사용되었다. 상동나무 가지 추출물들은 본 연구에서 dimethyl sulfoxide (DMSO)에 용해하여 사용되었으며, 대조군이 DMSO를 0.1%를 초과하지 않도록 하였다.
세포 생육 억제활성 측정
분석을 위해 사용된 인간 대장암 세포인 HCT116은 한국세포주은행에서 구매하였으며, HCT116 세포는 10% fatal bovine serum (FBS), 100 U/mL penicillin and 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 5% CO₂ 하로 유지한 조건에서 배양하였다. HCT116 세포의 세포생육 억제활성을 측정하는 데에 MTT assay를 이용하였다. HCT116세포는 96 well plate에서 well 당 1 × 10⁵ cells로 24시간 배양 후 상동나무 가지 ethanol 추출물들을 ethanol 추출 농도 및 각 추출물의 농도별로 24 시간 동안 처리하였다. 처리 24시간 후 각 well에 MTT (1 ㎎/mL) 용액 50 ㎕씩 첨가하여 2시간 동안 배양시킨 후, 상등액을 제거하여 형성된 formazan만을 남겼다. 상등액이 제거된 formazan에 DMSO를 100 μL를 각각의 well에 첨가하여 formazan이 보이지 않도록 녹인 후 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 흡광도를 570 ㎚에서 측정하였다.
SDS-PAGE 및 Western blot 분석
대장암 세포인 HCT116로부터 단백질 추출을 하기 위해, 시료처리 후 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척하여 회수하였다. Protease inhibitor cocktail (Sigma-Aldrich, St. Louis, MO, USA)과 phosphatase inhibitor cocktail (Sigma-Aldrich, St. Louis, MO, USA)이 포함된 NP-40 lysis buffer (GenDEPOT, Katy, TX, USA)를 4℃ 하에 30분 반응시켜 원심 분리 후 상등액을 취하였다. 상등액을 취하여 얻은 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석을 실시하였다. 정량분석 후 동일량의 단백질을 12% SDS-acrylamide gel로 전기영동을 하여 PVDF membrane (BioRad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk을 사용하여 상온에서 1시간 동안 blocking 하였다. Blocking 후, 5% non-fat dry milk에 용해시킨 1차 항체를 4℃ 하에 16시간 동안 membrane에 반응시킨 후, membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 세척 후 2차 항체를 5% non-fat dry milk에 용해시켜 상온에서 membrane에 1시간 반응시켰다. 1시간 후 TBS-T로 5분 간격으로 3회 세척하여 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
통계분석
본 연구의 결과는 3 회 반복하여 측정하였으며 평균 ± 표준편차로 나타내었다. Student’s t-test (EXCEL, Microsoft Corporation, Redmond, Washington, USA)로 처리 간 유의성을 검증하여 0.05 미만의 p-value 값일 경우, 통계상으로 유의하다고 판단하였다.
결과 및 고찰
STB의 HCT116세포에 대한 apoptosis유도를 통한 세포생육 억제활성
상동나무 가지(STB)의 대장암 세포인 HCT116 세포에 대한 세포생존 억제유도활성을 평가하기 위해 농도별 ethanol에 추출한 STB 50 ㎍/mL를 HCT116세포에 24시간 처리하여 MTT assay를 통해 확인하였다. 그 결과, 40% ethanol 추출물을 처리한 구간부터 유의적으로 세포생존이 억제되었으며 100% ethanol 추출물을 처리한 구간에서 현저하게 세포생존이 억제됨을 확인하였다(Fig. 1A). 세포는 세포사멸이 일어나면 세포 간의 접착이 떨어지며 기포가 생기며 점차 chromatin의 응축이 진행된다(Wyllie et al., 1981). 그리하여 우리는 농도별 ethanol로 추출된 STB를 HCT116에 처리한 다음, STB가 대장암세포 HCT116세포의 chromatin응축을 유도하는지 확인하였다. 그 결과에서 STB의 ethanol 추출 농도에 따라 유의적으로 세포 내의 chromatin 응축을 동반하여 세포가 수축하였음을 확인하였다(Fig. 1A). 그리고 HCT116세포에 100% ethanol로 추출된 STB (STB-E100)를 농도별로 24시간 처리한 결과, STB-E100은 농도 의존적으로 HCT116세포의 생존이 억제되었고, 세포 내에서 기포가 생기며 chromatin응축이 일어나며 세포가 수축하는 것을 확인하였다(Fig. 1B). HCT116 세포에 STB-E100 25 ㎍/mL을 시간별로 처리한 결과, 24시간 처리한 구간에 현저하게 HCT116세포의 생존이 억제되었으며 세포 내 chromatin응축은 시간이 경과함에 따라 점차 일어나 24시간에서 세포수축이 일어났음을 확인하였다(Fig. 1C). Apoptosis는 세포 내에 진행되는 세포사멸에 대한 자연적인 메커니즘이다. 암세포는 apoptosis를 회피하는 특징이 있으며 apoptosis 조절기능 상실은 암세포의 생존을 오래 지속시키며 세포의 과증식을 유도하기 때문에 암예방에 있어 apoptosis는 중요한 메커니즘 중 하나이다(Pfeffer and Singh, 2018). HCT116세포에 대한 STB-E100의 세포생존 억제활성이 apoptosis유도에 의한 것인지 평가하기 위해 apoptosis 관련 단백질 cleaved PARP 발현을 조사하였다. HCT116세포에 STB-E100을 농도별로 24시간 처리한 결과, 농도의존적으로 cleaved PARP 단백질 수준 증가를 보였으며(Fig. 1D), STB-E100 25 ㎍/mL을 시간별로 처리하여 조사한 결과, 처리 후 24시간에 현저하게 cleaved PARP 발현이 나타나는 것을 확인하였다(Fig. 1E). 본 결과들은 STB-E100은 HCT116세포에 대한 세포생존 억제활성을 유의적으로 나타내며, 이는 STB-E100의 세포 내 apoptosis유도를 통한 세포생존 억제활성임을 의미한다.
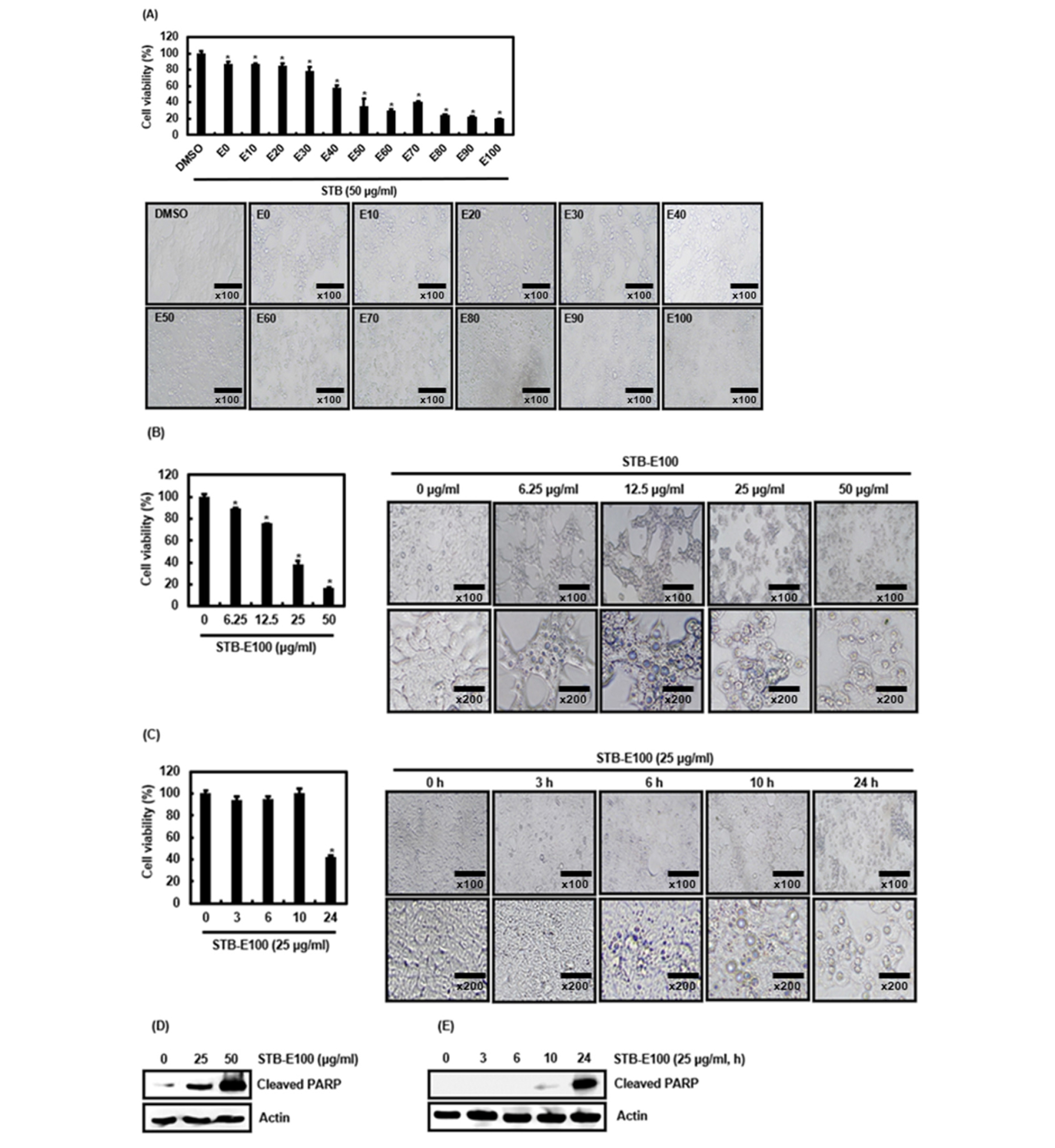
Fig. 1.
Effect of STB on the cell growth in HCT116 cells. (A) HCT116 cells were treated with ethanol dose-dependently extracts of STB (50 ㎍/mL) for 24 h. (B and D) HCT116 cells were treated with STB-E100 at the indicated concentrations for 24 h. (C and E) HCT116 cells were treated with STB-E100 (25 ㎍/mL) for the indicated times. Western blot analysis was performed against Cleaved PARP. Actin was used as internal controls for Western blot. ﹡p<0.05 compared to cell without STB.
HCT116세포에서 STB의 P65 핵내 전이를 통한 NF-κB 신호전달 활성화
세포생육에 관여하는 신호전달 경로는 MAPK, PI3K-Akt, NF-κB 신호전달 등이 있다(Lin et al., 2010). 그 중 NF-κB 신호전달은 암세포의 생육과 발달 그리고 증식에 관여하며 분자세포 수준에서 유전자 발현과 apoptosis를 조절한다(Hassanzadeh, 2011; Lin et al., 2010). 일반적으로 NF-κB 신호전달 활성화는 세포사멸을 억제하지만 세포 내에 세포사멸에 관여하는 암 치료에 잠재적 신호전달 표적으로 간주되기도 한다(Dolcet et al., 2005, Jeong et al., 2013). NF-κB 신호전달이 활성화되면 NF-κB복합체의 구성인자 중 P65가 핵내로 전이된다고 알려져 있다(Kole et al., 2011). HCT116세포에서 STB-E100의 NF-κB 활성화를 평가하기 위해 STB-E100의 p65 핵내 전이유도를 조사하였다. HCT116세포에서 STB-E100 25 ㎍/mL을 시간별로 처리한 후 핵내 P65 단백질 수준을 확인한 결과, 처리 후 6시간부터 유의적으로 p65가 핵내 전이가 되었음을 확인하였다(Fig. 2A). p65는 평소 NF-κB 복합체에 구성되어 있으면서 IκB-α와 결합한 형태이지만 외부자극을 통한 IκB-α의 분해로 p65의 핵내 전이가 일어난다고 알려져 있다(Lin et al., 2010). HCT116세포에서 STB-E100의 IκB-α분해를 평가하기 위해 세포질에서의 단백질 수준감소를 조사하였다. HCT116세포에서 STB-E100를 농도별로 24시간 처리한 결과, 농도의존적으로 IκB-α의 단백질 수준감소가 나타났으며(Fig. 2B), STB-E100 25 ㎍/mL을 시간별로 처리한 결과, 처리 후 10시간부터 유의적으로 IκB-α의 단백질 수준감소가 나타난다는 것을 확인하였다(Fig. 2C). 본 결과들은 STB-E100는 p65의 핵내 전이유도를 통해 NF-κB 신호전달을 활성화시키며 p65의 핵내 전이는 IκB-α의 단백질 수준감소로 IκB-α의 분해를 통해 나타난다는 것을 추정할 수 있다.
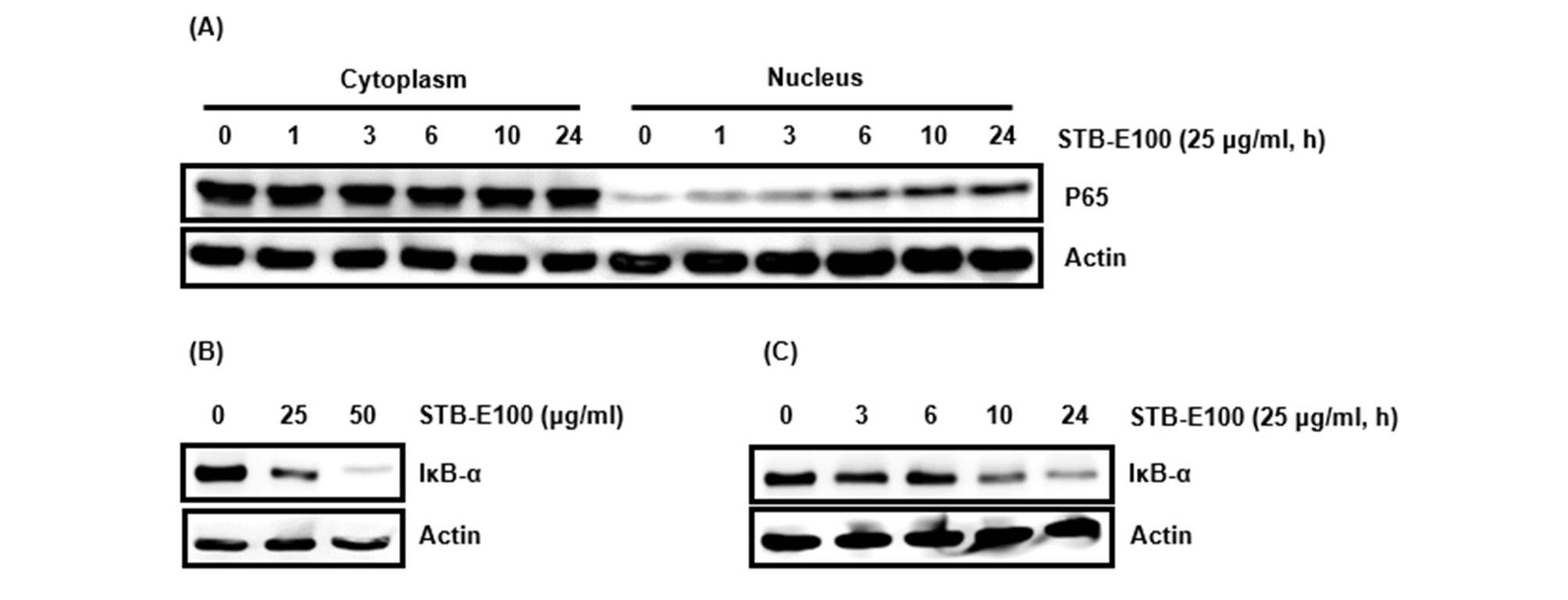
Fig. 2.
Effect of STB-100 on NF-κB activation in HCT116 cells. (A and C) HCT116 cells were treated with STB-E100 (25 ㎍/mL) for the indicated times. (B) HCT116 cells were treated with STB-E100 at the indicated concentrations for 24 h. Western blot analysis was performed against IκB-α and P65. Actin was used as internal controls for Western blot.
STB-E100의 IκB-α의 인산화를 통한 단백질 분해 유도활성
HCT116세포에서 STB-E100의 IκB-α 단백질 수준감소가 단백질 분해로 인한 수준감소인지 평가하기 위해 HCT116세포에 단백질 분해 억제제인 MG132 10 μM를 2시간 전처리한 후 STB-E100 25 ㎍/mL을 14시간 처리하여 IκB-α의 단백질 수준을 조사하였다. 그 결과, STB-E100을 처리한 구간에서는 IκB-α 단백질 수준감소가 나타났지만 MG132와 STB-E100을 함께 처리한 구간에서 단백질 수준감소가 줄어들었다는 것을 확인하였다(Fig. 3A). HCT116세포에 단백질 분해 억제제인 MG132 20 μM를 2시간 전처리한 후 STB-E100 25 ㎍/mL을 6시간 처리한 결과, STB-E100을 처리한 구간에서는 P65 핵내 전이가 나타났지만 MG132와 STB-E100을 함께 처리한 구간에서 P65 핵내 전이가 줄어들었다는 것을 확인하였다(Fig. 3B). 자극을 받아 NF-κB 신호전달이 활성화되면 IκB-α는 인산화를 통해 단백질 분해가 일어난다(Park et al., 2018). HCT116세포에서 STB-E100의 IκB-α 인산화를 평가하기 위해 HCT116세포에 STB-E100 25 ㎍/mL를 시간별로 처리하여 확인한 결과, 처리 후 1시간부터 인산화가 일어나 6시간부터 현저하게 일어났다가 24시간 줄어들었다(Fig. 3C). 본 결과들은 HCT116세포에서 STB-E100의 IκB-α의 인산화를 통한 단백질 분해가 일어나며 이로 인해 P65 핵내 전이를 유도한다는 것을 의미한다.
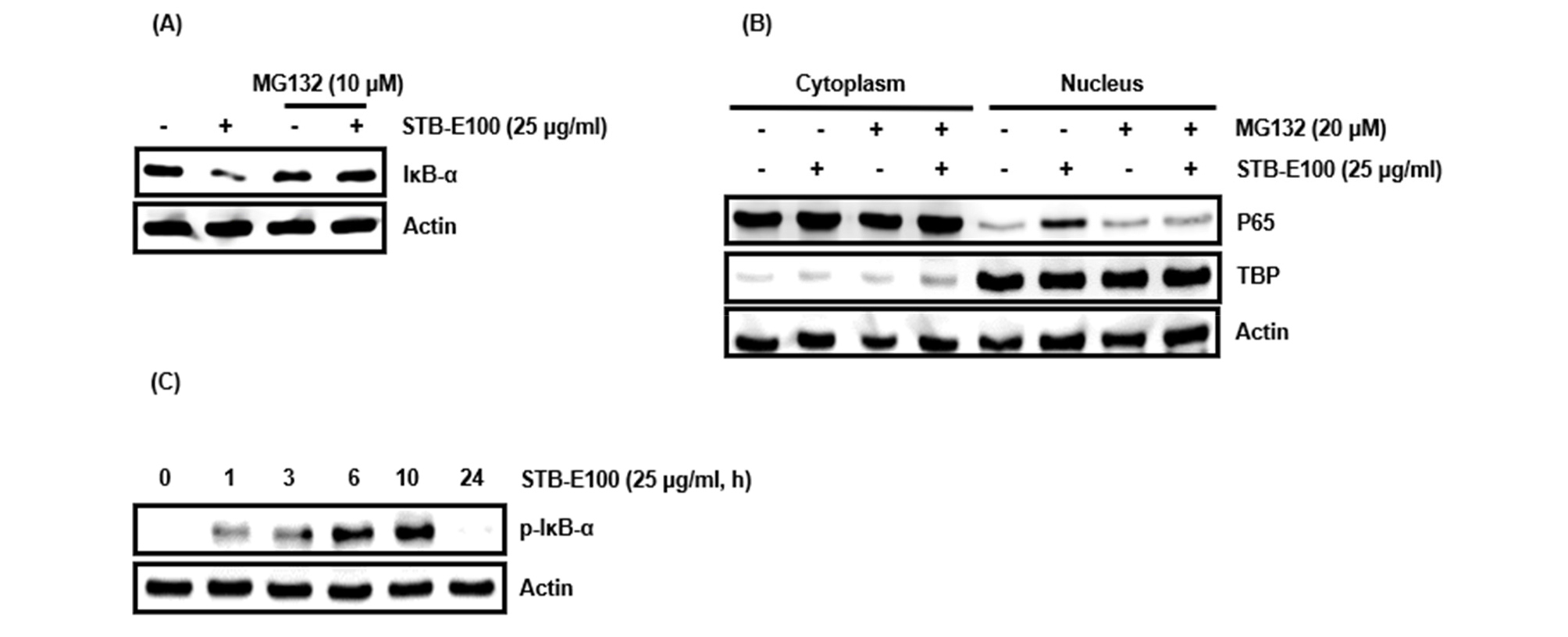
Fig. 3.
Effect of STB-E100 on IκB-α proteasomal degradation through IκB-α phosphorylation in HCT116 cells. (A) HCT116 cells were pretreated with MG132 (10 μM) for 2 h and then co-treated with STB-E100 (25 ㎍/mL) for 14 h. (B) HCT116 cells were pretreated with MG132 (20 μM) for 2 h and then co-treated with STB-E100 (25 ㎍/mL) for 6 h. (C) HCT116 cells were treated with STB-E100 (25 ㎍/mL) for the indicated times. Western blot analysis was performed against IκB-α, p-IκB-α and P65. Actin and TBP were used as internal controls for Western blot.
HCT116세포에서 STB-E100의 GSK3β 의존성 P65 핵내 전이 유도활성
NF-κB 신호전달의 활성화는 MAPKs, PI3K/Akt 등 다양한 신호전달의 관여로 일어난다고 알려져있다(Dolcet et al., 2005, Moon et al., 2018). HCT116세포에서 STB-E100의 의해 P65 핵내 전이 유도와 관련된 kinase를 구명하기 위해, HCT116세포에 ERK1/2 억제제인 PD98059 (20 μM), p38 억제제인 SB203580 (20 μM), JNK 억제제인 SP600125 (20 μM), IKK 억제제인 BAY11-7082 (20 μM), GSK3β 억제제인 LiCl (20 mM) 그리고 PI3K 억제제인 LY294002 (20 μM)를 각각 2시간 동안 전처리 후, STB-E100 25 ㎍/mL을 6시간 동안 처리하고 P65 핵내 전이를 확인하였다. 그 결과, LiCl이 처리된 HCT116세포에서는 STB-E100의 P65 핵내 전이 유도가 줄어들었으나(Fig. 3D) PD98059, SB203580, SP600125, BAY11-7082, LY294002이 처리된 HCT116 세포에서는 STB-E100가 유도하는 P65 핵내 전이가 줄어들지 않았다(Fig. 4A-C, 4E and F). 본 결과들은 STB-E100의 P65 핵내 전이 유도가 GSK3β 의존성이라는 것을 의미한다.
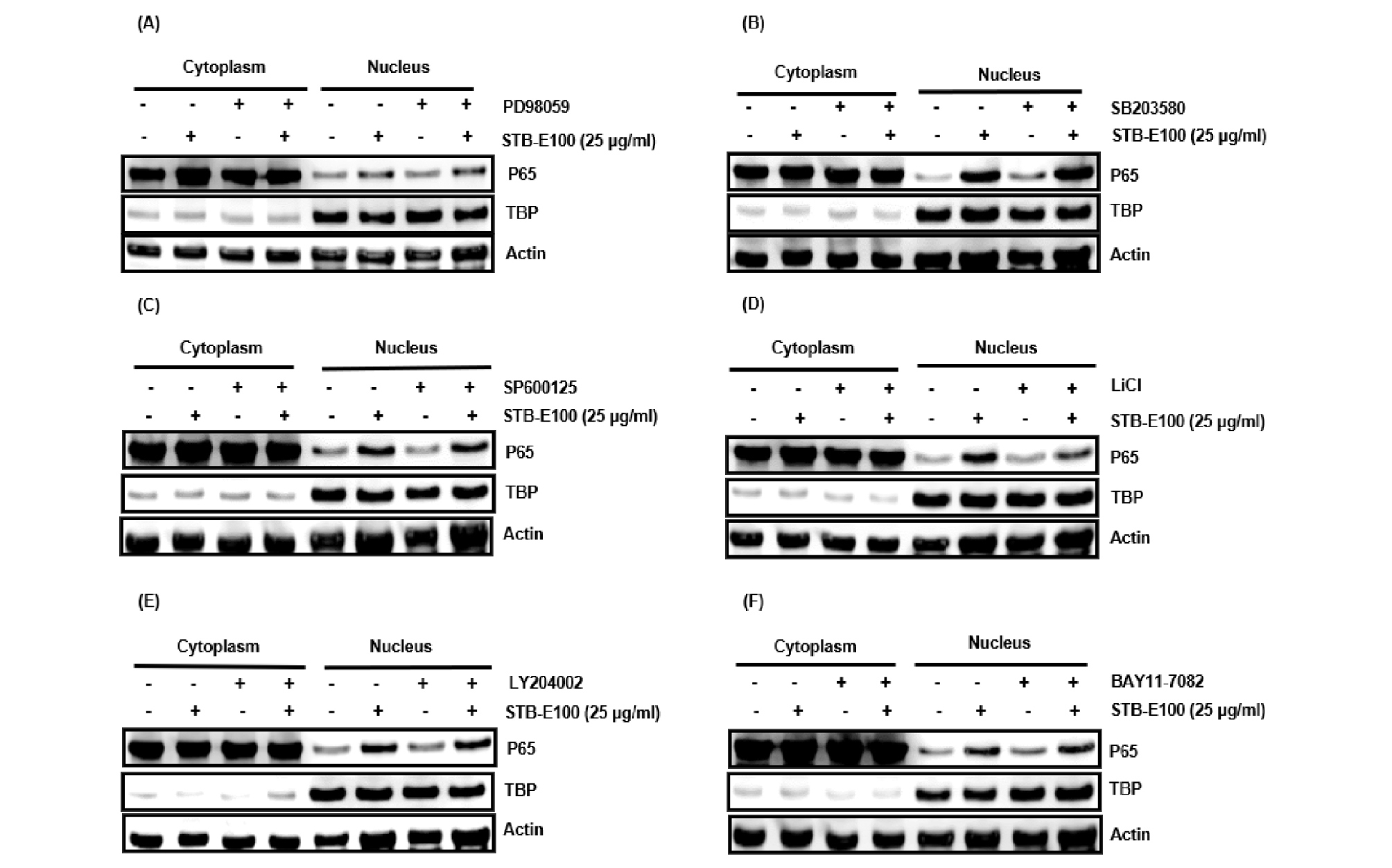
Fig. 4.
Effect of MAPKs, IKK, PI3K and GSK3β on P65 accumulation to nucleus by STB-E100 in HCT116 cells. (A-F) HCT116 cells were pretreated with PD98059 (20 μM), SB203580 (20 μM), SP600125 (20 μM), BAY11-7082 (20 μM), LY294002 (20 μM) and LiCl (20 mM) for 2 h, and then co-treated with STB-E100 (25 ㎍/mL) for 6 h. Western blot analysis was performed against p65. Actin and TBP were used as internal controls for Western blot.
STB-E100의 HCT11세포에서 GSK3β 활성화 유도활성
앞서 HCT116세포에서 STB-E100의 P65 핵내 전이 유도가 GSK3β 의존성임을 확인하였다. GSK3β는 NF-κB 신호전달의 전사 복합체 수준에 영향을 주어 NF-κB 신호전달의 활성화를 용이하게 한다(Hoeflich et al., 2000). 다양한 세포의 성장 신호전달경로 뿐만 아니라 apoptosis에도 관여하는 GSK3β는 인산화를 통해 활성화된다(Yun et al., 2009). HCT116세포에서 STB-E100이 GSK3β를 활성화시키는지 평가하기 위해 HCT116세포에 STB-E100 25 ㎍/mL을 시간별로 처리하였다. 그 결과, 처리 후 1시간부터 현저하게 GSK3β가 인산화 되었고 점차 줄어들었다(Fig. 5A). HCT116 세포에서 STB-E100의 GSK3β 활성화가 IκB-α 단백질 분해에 관여하는지 평가하기 위해 GSK3β 억제제인 LiCl (20 mM)을 각각 2시간 동안 전처리 후, STB-E100 25 ㎍/mL을 14시간 동안 처리하고 IκB-α 단백질 수준을 확인하였다. 그 결과, LiCl을 HCT116세포에서 STB-E100의 IκB-α 단백질 수준 감소는 줄어들지 않았다(Fig. 5B). 본 결과들을 미뤄볼 때, HCT116세포에서 STB-E100은 GSK3β를 활성화시켜 p65 핵내 전이를 유도하지만 STB-E100의 IκB-α 단백질 분해는 GSK3β 의존성이 아니라는 것을 확인하였다.
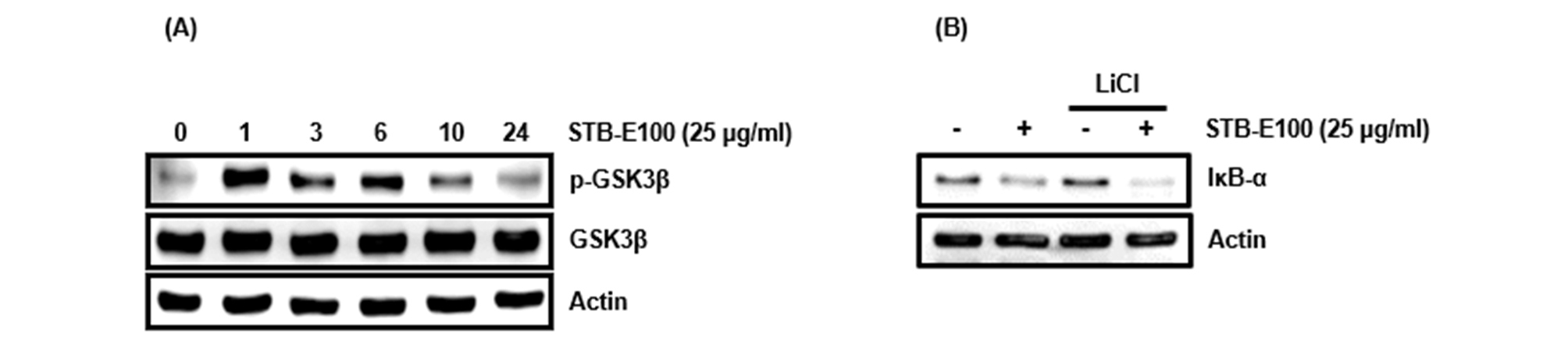
Fig. 5.
Effect of STB-E100 on GSK3β activation and IκB-α proteasomal degradation through GSK3β activation in HCT116 cells. (A) HCT116 cells were treated with STB-E100 (25 ㎍/mL) for the indicated times. (B) HCT116 cells were pretreated with LiCl (20 mM) for 2 h, and then co-treated with STB-E100 (25 ㎍/mL) for 14 h. Western blot analysis was performed against IκB-α, p-GSK3β and GSK3β. Actin was used as internal controls for Western blot.
적 요
본 연구에서 상동나무 가지 추출물(STB-E100)은 대장암 세포에서 세포사멸을 유도하여 세포생육을 억제하였다. 또한 IκB-α 인산화를 통한 IκB-α 단백질 분해를 유도하며 이로 인해 P65 핵내 전이를 유도하여 NF-κB 신호전달을 활성화시킨다. NF-κB 신호전달 활성화는 GSK3β 활성화를 통해 P65 핵내 전이를 유도에 의한 것이지만 IκB-α분해는 GSK3β 의존성이 아니다. 상동나무 가지 추출물은 이러한 신호전달 활성화를 통해 세포사멸을 유도하여 대장암의 세포생육을 억제한다. 본 결과를 바탕으로 상동나무 가지가 암 예방 및 치료를 목적으로 한 표적 요법에서 항암제 개발의 잠재적 활용 소재로서 이용 가능하다고 사료된다. 그러나 대장암 세포에서 상동나무 가지 추출물에 의해 유도된 NF-κB 신호전달 작용기전을 좀 더 구체적으로 구명할 필요가 있고 대장암에 대한 세포사멸과 작용기전의 정확한 관련성을 조사하기 위해 추가적인 연구가 필요하다.




