서언
재료 및 방법
실험재료 및 추출물 조제
세포배양 및 MTT assay
DAPI staining에 의한 세포 핵의 형태 관찰
DNA fragmentation 분석
Annexin V-FITC/Propidium Iodide (PI) staining에 의한 apoptosis 분석
Western blot analysis에 의한 단백질 발현 분석
Mitochondrial membrane potential (MMP, Δψm) 변화의 측정
In vitro caspase activity 측정
통계 처리
결과 및 고찰
감초 열수추출물에 의한 인체 방광암 T24 세포의 증식 억제 및 apoptosis 유발
GRW 처리에 따른 Apoptosis 조절 유전자 발현 변화
MMP (Δψm) 변화에 미치는 GRW의 영향
Caspase의 활성 및 기질 단백질의 발현에 미치는 GRW의 영향
적요
서언
방광암은 방광에서 비정상적인 세포가 계속하여 증식하는 악성 종양을 말하며, 비뇨기계에서 발생하는 암 중 전립선암 다음으로 가장 흔한 종양이다. 최근 통계에 의하면 연령이 증가함에 따라 노인성 질환으로 방광암 발병률이 높아지며, 남성의 경우 여성에 비해 많이 발생하는 것으로 알려져 있다(Kirkali et al., 2005). 방광암은 수술 후에도 재발 확률이 높은 것으로 알려져 있어(Nargund et al., 2012; Smaldone et al., 2008) 치료 보다 효과적인 생리활성을 갖는 소재를 발굴하고 그와 관련된 분자 및 세포수준에서의 기전을 밝히는 것이 중요하다고 할 수 있다.
항암치료의 효과적인 전략은 다양한 기전을 통하여 암세포의 분열과 성장을 억제하고 선택적으로 암세포를 제거하는데 있다. 이러한 측면에서 특정 약물의 처리에 의한 암세포 특이적 프로그램화된 세포사멸 기전으로 알려져 있는 apoptosis 유발은 항암제 개발에 가장 중요한 영역으로 인식되고 있다(Kasibhatla and Tseng, 2003; Kerr et al., 1972). Apoptosis 기전으로 죽음 수용체(death receptor, DR)를 매개하는 외인적 경로(extrinsic pathway)와 미토콘드리아를 매개하는 내인적 경로(intrinsic pathway)로 구분되어진다. Apoptosis 기전은 죽음 수용체(death receptor, DR)를 매개하는 외인적 경로(extrinsic pathway)와 미토콘드리아를 매개하는 내인적 경로(intrinsic pathway)로 구분된다. Extrinsic pathway는 세포막에 존재하는 죽음 수용체에 특정 ligand가 결합함으로써 caspase-8의 활성화를 유발하여 effector caspase인 caspase-3를 직접적으로 활성화시켜 poly (ADP-ribose) polymerase (PARP)과 같은 기질 단백질들의 분해를 동반한 DNA 단편화 등을 통하여 apoptosis를 유발한다(Kaufmann et al., 1993; Lazebnik et al., 1994). 또한 intrinsic pathway의 경우에서는 Bcl-2 homology 3 (BH3)-only protein인 Bid의 단편화를 통해 intrinsic pathway를 경유하여 apoptosis를 유발하기도 한다(Li et al., 1998; Luo et al., 1998). 반면 intrinsic pathway는 미토콘드리아 막 붕괴와 연관이 있으며, 이는 caspase-9의 활성에 의해 최종 effector caspase (caspase-3/-7)의 활성을 통하여 apoptosis를 유도한다(Han et al., 2008; Li et al., 1997). 이러한 두 경로의 주요 조절인자인 caspase 효소들은 inhibitor of apoptosis proteins (IAPs) family에 속하는 단백질들과의 직접적인 결합을 통하여 그들의 apoptotic 활성이 억제될 수 있다(Salvesen and Duckett, 2002).
감초(Glycyrrhizae radix)는 콩과에 속하는 다년생 초본으로 예로부터 진해(鎭咳), 해독(解毒), 거담(祛痰), 이뇨(利尿)작용 등을 치료하기 위해 한방에서 널리 사용되어 왔으며(Lee et al., 2010; Lee et al., 2009), 주로 한국과 중국에서 재배되는 감초(Glycyrrhiza uralensis Fischer, G. uralensis)와 유럽에서 재배되는 감초(Glycyrrhiza glabra L.)가 있다(Lee et al., 2010). 감초의 주요 생리활성 성분은 triterpene계 saponin 성분으로는 glycyrrhizin (glycyrrhizic acid)과 glycyrrhetinic acid 등이 있으며, flavonoid 성분으로는 liquiritin, liquiritigenin, isoliquiritin, isoliquiritigenin, apioliquiritin, glycyrol, glycyrin, licoricidin, licoricone 등이 있고, phenol성 물질로서 licopyranocoumarin, glycocoumarin 등의 성분이 밝혀져 있다(Lee et al., 2010; Park et al., 2008). 최근 연구에 의하면 항산화, 항염증 효과(Siracusa et al., 2011) 뿐만 아니라, 세포주기 억제 및 apoptosis 유발 등과 같은 항암활성을 가지는 것으로 보고되고 있다(Yamazaki et al., 2002). 하지만 감초 추출물에 의해 유발하는 항암활성 작용 및 그에 따른 분자생물학적 기전에 대해서는 명확히 밝혀져 있지 않다.
따라서 본 연구에서는 감초 열수추출물이 인체 방광암 T24 세포에 미치는 항암 효과의 생화학적 기전의 해석을 위하여 T24 세포의 증식에 미치는 영향을 조사하였고, 감초 열수추출물이 유발하는 증식억제 현상이 apoptosis에 어떠한 영향을 미치는지를 조사하여 유의적인 결과를 얻었기에 이를 보고하는 바이다.
재료 및 방법
실험재료 및 추출물 조제
본 실험에 사용한 감초 시료는 ㈜서경한방약업사(Busan, Republic of Korea)에서 파쇄된 상태로 구입하였으며, 본 표본은 국립낙동강생물자원관 자원은행부에 보관하고 있다(FBCC-EP-83). 감초 열수 추출물(water extract of Glycyrrhizae radix, GRW)을 얻기 위하여 시료 무게의 10배에 해당하는 증류수로 100℃에서 3시간 동안 추출하였다. 열수 추출물을 여과지(Whatman No. 3 filter paper, Whatman International Ltd., Maidstone, England)로 여과한 후 용매를 Rotary evaporator (Eyela, A-1000, Tokyo Rikakikai Co., Tokyo, Japan)를 이용하여 농축하고, 각 농축물은 동결 건조하여 분말화시켰다. 이후 열수 추출물은 멸균 증류수에 100 ㎎/mL의 농도로 녹이고, MinisartⓇ Syringe filter (0.2 ㎛, Sartorius AG, Weender Landstr. Germany)로 거른 후 -20℃에서 보관하며 실험에 따라 적절하게 희석하여 사용하였다.
세포배양 및 MTT assay
T24 세포는 American Type Culture Collection (Rockville, MD, USA)에서 분양받아, 10% fetal bovine serum (FBS, Gibco BRL, Gaithersburg, MD, USA) 및 1% penicillin–streptomycin이 함유된 RPMI 1640 배지를 사용하여 37℃, 5% CO2 조건에서 배양하였다. GRW 처리에 따른 세포 증식 억제 정도를 측정하기 위하여 6-well plate에 T24 세포를 well당 3×105개를 분주하고 GRW를 적정 농도로 처리하여 배양하였다. 그 후 MTT 시약을 0.5 ㎎/mL 농도가 되게 처리하여 2시간 동안 배양하고, 배지를 제거한 후 DMSO를 2 mL씩 분주하여 생성된 formazan을 모두 녹인 후 ELISA reader (Molecular Devices, Sunnyvale, CA, USA)로 540 ㎚에서 흡광도를 측정하였다. 또한 세포의 생존율을 측정하기 위하여 위와 같은 조건으로 세포를 배양한 후 배지를 제거하고 phosphate-buffered saline (PBS)를 각 well 당 1 mL을 첨가하여 세포를 부유시킨 다음 0.5% trypan blue solution (Gibco-BRL)을 동량으로 첨가하여 2분간 처리하였다. 처리된 sample을 hemocytometer에 적용한 후 도립 현미경(Carl Zeiss, Germany)을 이용하여 살아있는 세포의 수를 비교하였다.
DAPI staining에 의한 세포 핵의 형태 관찰
Apoptosis가 유발되었을 경우 특이적으로 나타나는 핵의 형태적 변화를 관찰하기 위하여 GRW이 처리된 세포를 모은 다음 2,000 rpm으로 5분간 원심 분리하여 상층액을 제거하고 37% formaldehyde 용액과 PBS를 1:9 비율로 섞은 fixing solution을 모아진 세포에 500 μL 첨가하여 충분히 섞은 후, 상온에서 10분 동안 고정하였다. 고정된 세포를 2,000 rpm으로 5분간 원심 분리하여 fixing solution을 제거하고 PBS 200 μL에 부유시킨 후 세포가 포함되어 있는 PBS 80 μL를 slide glass 위에 떨어뜨리고 1,000 rpm에서 5분간 cytospin하여 세포를 slide glass에 부착하였다. 세포가 부착된 slide glass를 PBS로 2~3회 정도 세척하고 PBS가 마르기 전에 0.2%의 Triton X-100 (SigmaAldrich Co.)을 첨가하여 상온에서 10분간 고정한 후 2.5 ㎍/mL 농도의 DAPI 용액을 처리하여 상온에서 15분간 염색하였다. 염색이 끝난 후 DAPI 용액을 충분하게 세척하고 mounting solution을 처리한 후 형광 현미경(Carl Zeiss, Oberkochen, Germany)을 이용하여 ×400배의 배율로 각 농도에 따른 암세포 핵의 형태 변화를 관찰하였다.
DNA fragmentation 분석
Apoptosis 유발의 또 다른 증거를 제시하기 위하여 DNA 단편화 현상의 분석을 실시하였다. 상기와 동일한 방법으로 처리된 세포들을 모은 다음 lysis buffer [5 mM Tris-HCl (pH 7.5), 5 mM EDTA, 0.5% Triton X-100]를 첨가하여 상온에서 1시간 동안 처리한 다음 상층액을 회수하였다. 회수된 상층액에 proteinase K solution (Sigma-Aldrich)을 처리하여 50℃에서 3시간 동안 반응시킨 후 phenol : chloroform : isoamyl alcohol 혼합 용액(25:24:1, Sigma-Aldrich)을 첨가하고 30분간 회전교반 시킨 다음 원심분리하여 다시 상층액을 분리하였다. 분리된 상층액에 isopropanol (Sigma-Aldrich)과 5 M NaCl를 첨가하여 4℃에서 24시간 동안 반응시킨 후 원심분리시켜 DNA pellet을 추출하였다. 추출된 DNA pellet에 RNase A가 포함된 TE buffer 및 6X gel loading dye (Bioneer, Daejeon, Korea)를 첨가하고 1.6% agarose gel을 이용하여 50 V 전기영동 시킨 후 ethidium bromide (EtBr, Sigma-Aldrich)로 염색하여 DNA 단편화 현상을 확인하였다.
Annexin V-FITC/Propidium Iodide (PI) staining에 의한 apoptosis 분석
GRW이 유발하는 apoptosis 정도를 정량적으로 분석하기 위하여 정상 및 GRW이 24시간 동안 처리된 세포들을 모은 다음 원심분리하여 상층액을 제거한 후 PBS를 이용하여 세척하였다. 준비된 세포를 10 mM HEPES/NaOH, pH 7.4, 140 mM NaCl and 2.5 mM CaCl2가 포함된 annexin V binding buffer (Becton Dickinson, San Jose, CA, USA)에 부유시킨 다음 annexin V-FITC 및 propidium iodide (PI, Becton Dickinson)를 처리하여 암실에서 20분 동안 반응을 시켰다. 반응시킨 세포를 35-㎜ mesh를 이용하여 단일세포로 분리한 후 DNA flow cytometer (FACSCalibur, Becton Dickinson)에 적용시켜 apoptosis가 유발된 세포(V+/PI-)를 형광반응에 따라 측정한 후 CellQuest software 및 ModiFit LT 프로그램을 이용하여 분석하였다.
Western blot analysis에 의한 단백질 발현 분석
번역 수준에서 해당 유전자들의 발현 변화 조사를 위한 총 단백질은 lysis buffer [25 mM Tris-Cl (pH 7.5), 250 mM NaCl, 5 mM EDTA, 1% NP-40, 1 mM phenymethylsulfonyl fluoride (PMSF), 5 mM dithiothreitol (DTT)]를 첨가하여 4℃에서 1시간 동안 반응시킨 후, 14,000 rpm으로 30분간 원심분리하여 상층액에 있는 total 단백질을 분리하였다. 분리된 단백질 농도는 Bio-Rad 단백질 정량 시약(Bio-Rad, Hercules, CA, USA)과 그 사용방법에 따라 정량한 다음 동량의 Laemmli sample buffer (Bio-Rad)를 섞어서 sample을 만들었으며, Western blot analysis를 위해 동량의 sample을 sodium dodecyl sulfate (SDS)–polyacrylamide gel electrophoresis를 이용하여 분리하고 nitrocellulose membrane (Schleicher & Schuell, Keene, NH, USA)으로 전이시켰다. 각각의 membrane을 5% skim milk를 처리하여 비특이적인 단백질들에 대한 blocking을 실시하고 1차 항체를 처리하여 상온에서 2시간 이상 또는 4℃에서 over night 시킨 다음 PBS-T로 세척(15분간 1번, 5분간 5번)하고 처리된 1차 항체에 맞는 2차 항체(PBS-T로 1:1000 희석하여 사용)를 사용하여 상온에서 1시간 정도 반응시켰다. 반응이 끝난 후 암실에서 Enhanced chemiluminoesence (ECL) solution (Amersham Life Science Co.)을 적용시킨 다음 X-ray film에 감광시켜 특정 단백질의 발현량을 분석하였다.
Mitochondrial membrane potential (MMP, Δψm) 변화의 측정
MMP 값의 변화 여부를 조사하기 위하여 dual-emission potential-sensitive probe인 5,5',6,6'-tetrachloro-1,1',3,3'tetraethyl-imidacarbocyanine iodide (JC-1, Sigma-Aldrich Co.)를 사용하였다. 적정 시간 GRW가 처리된 세포를 모은 후, 10 μM의 JC-1 용액을 이용하여 실온 및 암하의 조건에서 염색을 시켰다. 30분 후, JC-1 용약을 제거하고 PBS로 수세한 후 FACSCalibur를 이용하여 MMP의 양적 변화를 조사하였다.
In vitro caspase activity 측정
Apoptosis 유발에 있어서 중요한 작용을 하는 것으로 알려진 caspase-3/-8/-9의 활성 정도를 정상 및 GRW가 처리된 배지에서 colorimetric assay kits (R&D Systems, Minneapolis, MN, USA)를 사용하여 제시된 방법에 준하여 활성의 증감여유를 조사하였다. 24시간 배양된 세포를 모은 뒤 상기와 동일한 방법으로 단백질을 추출하고 정량하여 각각 20 ㎍의 단백질을 fluorogenic peptide 기질 100 μM이 함유된 50 μL의 extraction buffer [40 mM 4-(2-hydroxyethyl)-1-piperazineethanesul fonic acid (pH 7.4), 20% glycerol (v/v), 1 mM EDTA, 0.2% NP-40 및 10 mM DTT]에 혼합하였으며, microplate에 다시 extraction buffer에 희석하여 각 sample 당 총 volume이 100 μL가 되게 하였다. 준비된 plate를 37℃에서 2시간 동안 반응시킨 후 ELISA reader (Versa max, Molecular Devices, CA, USA)를 이용하여 405 ㎚의 흡광도를 이용하여 반응의 정도를 측정하였다. 실험에 사용된 기질은 caspase-3의 경우에는 Asp-Clu-Val-Asp (DEVD)- p-nitroaniline (pNA), caspase-8 의 경우에는 Ile-Glu-Thr-Asp (IETD)-pNA이었으며, caspase-9는 Leu-Glu-His-Asp (LEHD)- pNA를 사용하였다.
통계 처리
실험 결과들의 유의성을 검정하기 위하여 분산분석(ANOVA)을 실시한 후 p<0.05 수준에서 Duncan’s multiple range tests를 실시하였으며, 그 결과는 평균(mean) ± 표준편차(standard deviation, SD)로 표시하였다. 이때 사용한 모든 통계분석은 SPSS 17.0 (IBM SPSS Inc, New York, USA) 통계 프로그램을 이용하여 처리하였다.
결과 및 고찰
감초 열수추출물에 의한 인체 방광암 T24 세포의 증식 억제 및 apoptosis 유발
인체 방광암 T24 세포의 증식에 미치는 감초 열수추출물(GRW)의 영향을 알아보기 위하여 GRW를 적정농도로 처리하여 24시간 동안 배양한 후 hemocytometer counting 및 MTT assay를 실시하였다. Fig. 1A 및 1B에 나타난 바와 같이 GRW의 처리 농도 의존적으로 T24 세포의 생존율 및 증식 억제가 유의하게 감소되었다. 아울러 GRW 처리에 의해 유발되는 생존율 및 증식 억제가 apoptosis 유발과 직접적인 연관성이 있는지를 확인하기 위하여 정상 및 GRW를 적정농도로 처리한 배지에서 24시간 동안 배양된 T24 세포에서 핵의 형태변화, DNA 단편화 현상 및 annexin V-FITC/PI 염색을 통하여 조사하였다. 먼저 핵의 형태변화를 확인하기 위하여 DAPI 염색을 실시하고 형광현미경으로 관찰한 결과 Fig. 2A에 나타난 바와 같이 정상 배지에서 배양된 세포와는 다르게 GRW 처리 농도 증가에 따라 전체적인 핵의 밀도 감소와 더불어 apoptosis가 유발된 세포에서 전형적으로 관찰되는 염색질 응축에 의한 apoptotic body의 형성이 관찰되었다. 다음으로 apoptosis 유발의 또 다른 증거인 DNA 단편화 현상은 apoptosis가 일어난 세포들에서 나타나는 전형적인 현상으로서 핵 내의 endonuclease가 활성화되어 chromosomal DNA를 단편화시킴으로서 나타나는 것으로 알려져 있다(Yoshida et al., 2006). 이를 위하여 정상 및 GRW가 함유된 배지에서 자란 세포를 대상으로 총 DNA를 추출하여 agarose gel 전기영동으로 조사한 결과는 Fig. 2B에 나타난 바와 같다. 결과에서 볼 수 있듯이 GRW 200 ㎍/mL 처리군까지는 DNA 단편화 현상이 나타나지 않았지만 400 ㎍/mL 처리군에서 약한 DNA 단편화 현상이 관찰되기 시작하여 600 ㎍/mL 처리군에서부터 DNA 단편화 현상이 강하게 나타나는 것으로 조사되었다. 이러한 결과들을 살펴볼 때 GRW는 T24 세포에서 apoptosis를 유발한다는 것을 알 수 있었으며, 이러한 apoptosis 유발의 정량적인 분석을 위하여 annexin V-FITC/PI로 염색한 후 DNA flow cytometry 분석을 실시하였다. Fig. 2C에 나타난 바와 같이 정상배지에서 자란 세포의 apoptosis 유발 빈도는 약 3.79% 정도였지만 GRW 처리농도 증가에 따라 apoptosis 유발 빈도가 증가하여 최고 농도인 600 ㎍/mL 처리군에서는 약 57.58%의 세포에서 apoptosis가 유발되는 것으로 나타났다. 이상의 결과를 살펴볼 때 인체 방광암 T24 세포에서 GRW 처리에 의한 생존율 감소, 증식 억제 및 형태변화는 apoptosis 유발과 밀접한 연관성이 있음을 알 수 있었다.
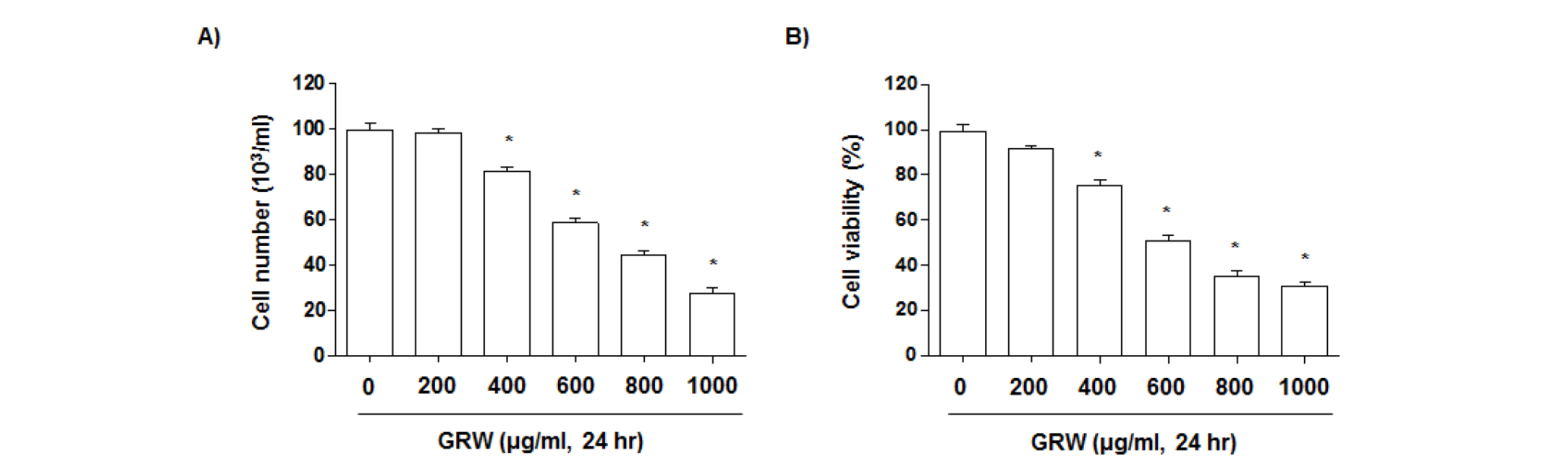
Fig. 1.
Inhibition of cell proliferation by GRW in T24 human bladder cancer cells. Cells were seeded in 6 well plate at 3×105 cells/mL and treated with the indicated concentrations of GRW for 24 hr. Cell number (A) and viability (B) were measured by the metabolic-dye-based MTT assay and trypan blue assay, respectively. Each point represents the mean ±SD of three independent experiments. The significance was determined by the Student’s t-test (*p<0.05 vs. untreated control).
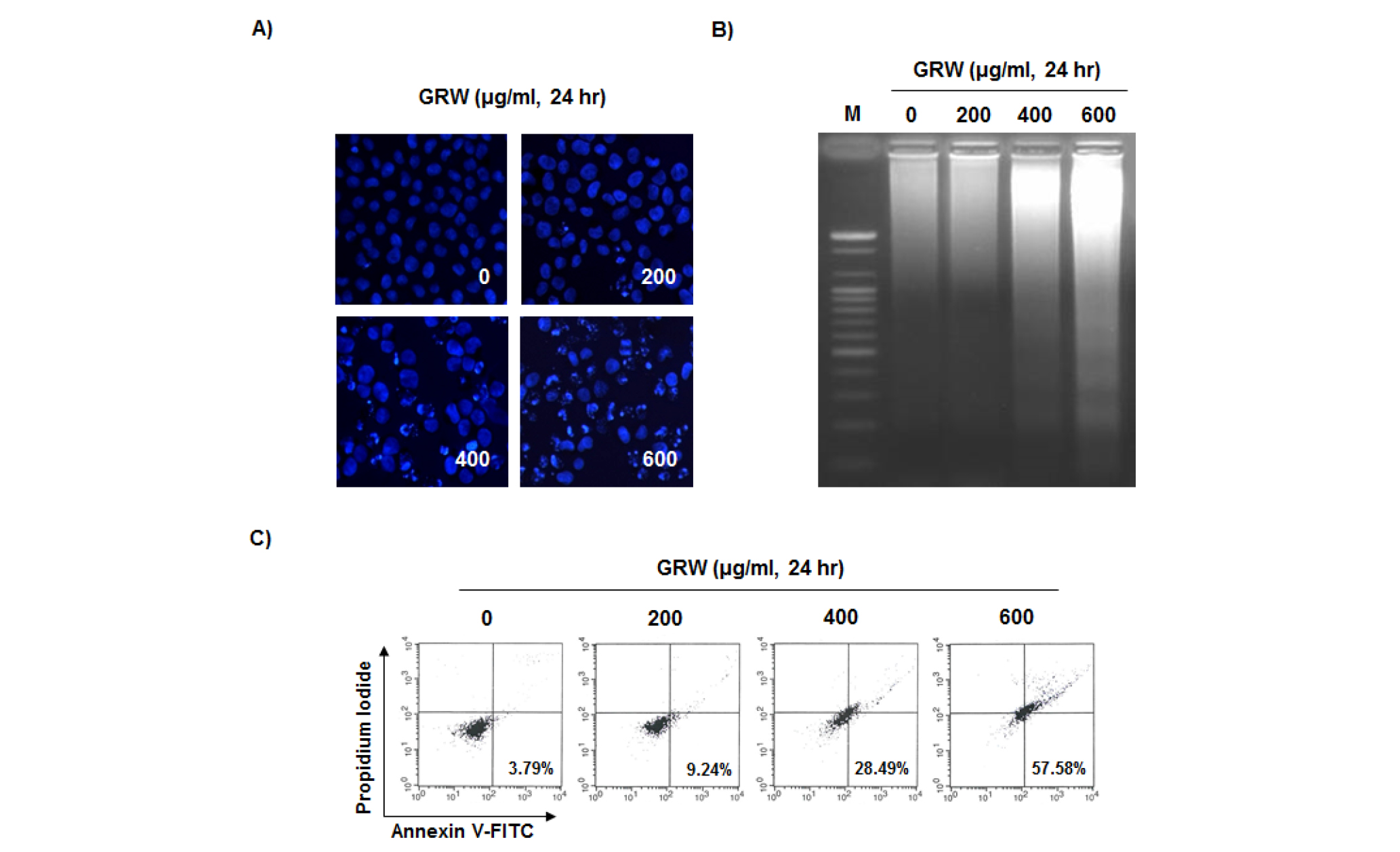
Fig. 2.
Induction of apoptosis by GRW in T24 human bladder cancer cells. (A) The cells were fixed and stained with DAPI solution. The stained nuclei were photographed with a fluorescence microscope using blue filter. (Original magnification, ×400). (B) The DNA fragmentations were separated on 1.6% agarose gel electrophoresis and visualized under UV light after staining with EtBr. (C) To quantify the degree of apoptosis induced by GRW, cells were stained with FITC-conjugated Annexin V and PI for DNA flow cytometry analysis. Apoptotic cells are determined by counting the % of annexin V+/PI- cells.
GRW 처리에 따른 Apoptosis 조절 유전자 발현 변화
다음은 apoptosis 유발 조절에 있어서 가장 대표적인 유전자로 알려진 Bcl-2 family 인자들의 발현에 미치는 GRW의 영향을 Western blotting을 이용하여 조사하였다. 그 결과 Bcl-2 family에 속하는 인자들 중, pro-apoptotic 유전자로 알려져 있는 Bax의 발현이 GRW 처리 농도 의존적으로 현저하게 증가되었으며, anti-apoptotic 유전자인 Bcl-2 및 Bcl-xL의 발현은 현저히 감소하는 것을 확인하였다. 또한 세포질에 있는 Bid의 경우 caspase-8의 활성화에 의해 truncation이 일어나 tBid로 되면 mitochondria로 이동하여 intrinsic 경로를 증폭시키는 단백질로 알려져 있으며, GRW 처리 시 total Bid의 발현이 감소함을 확인하였다(Fig. 3A). 한편 apoptosis 유도에 중심적인 역할을 하는 caspase 유전자들의 활성을 억제하는 IAP family (XIAP, cIAP-1 및 cIAP-2)의 발현 변화를 Western blotting을 통해 관찰하였으며, 조사된 3가지 IAP family 인자들의 발현이 GRW 처리에 의하여 현저하게 감소되었다(Fig. 3B). 이상의 결과를 살펴볼 때 GRW에 의해 유발되는 apoptosis 경로에는 Bcl-2 및 IAP family 인자들의 발현 변화가 중요한 역할을 한다는 것을 알 수 있었다.
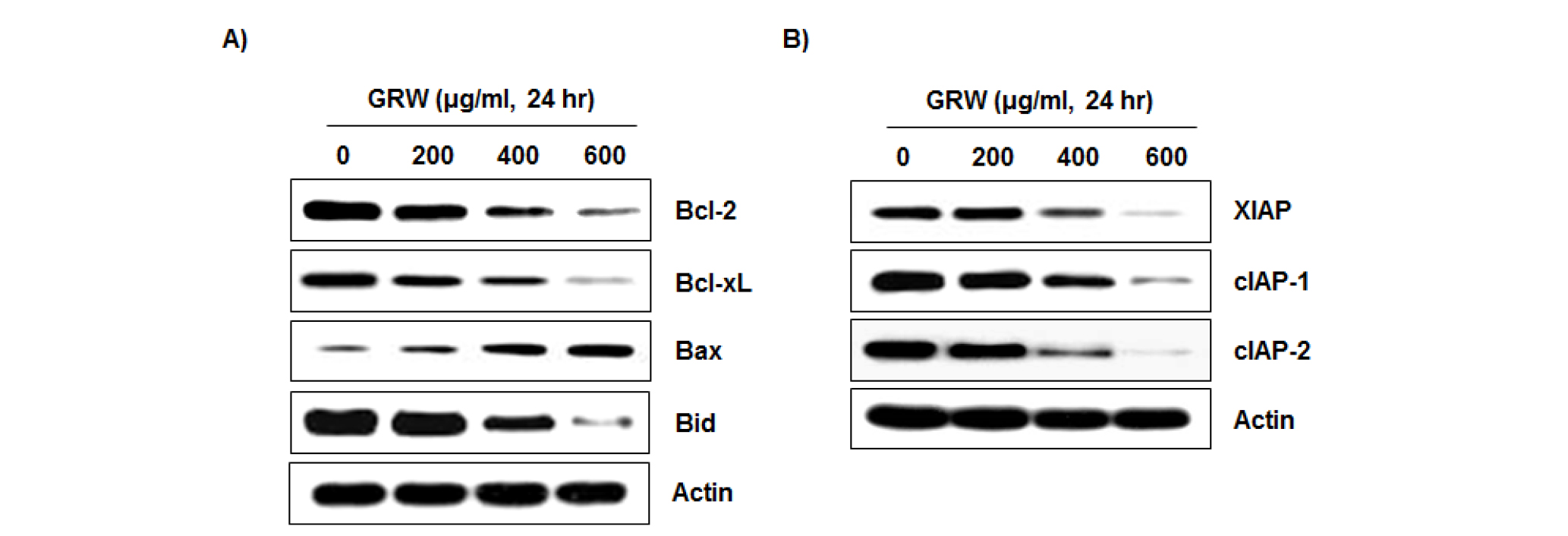
Fig. 3.
Effects of GRW on the expression of Bcl-2 and IAP family proteins in T24 human bladder cancer cells. Cells were treated with GRW for 24 hr, and aliquots containing total proteins were subjected to SDS-polyacrylamide gels followed by immunoblot analysis with specific antibodies against Bcl-2 (A) and IAP (B) family proteins, and an ECL detection system. Actin was used as an internal control.
MMP (Δψm) 변화에 미치는 GRW의 영향
GRW에 의한 apoptosis의 유발에는 미트콘드리아 막의 기능 손상이 연관되었을 것으로 추정되어, Fig. 4에 나타난 바와 같이 GRW를 처리하지 않았을 경우에는 정상적인 MMP를 가진 세포는 약 96.37%, 손상된 MMP를 가진 세포는 약 3.63%로 나타났지만 GRW 처리농도 증가에 따라서 MMP 손상 정도가 증가하였으며, 최고 농도인 600 ㎍/mL 처리군에서는 약 69.27% 정도의 세포에서 MMP의 손상이 유발되는 것으로 나타났다. 이상의 결과에서 GRW에 의하여 유발되는 apoptosis는 미트콘드리아 막의 손상을 통한 미토콘드리아 기능 이상이 관여하고 있다는 것을 알 수 있었다.
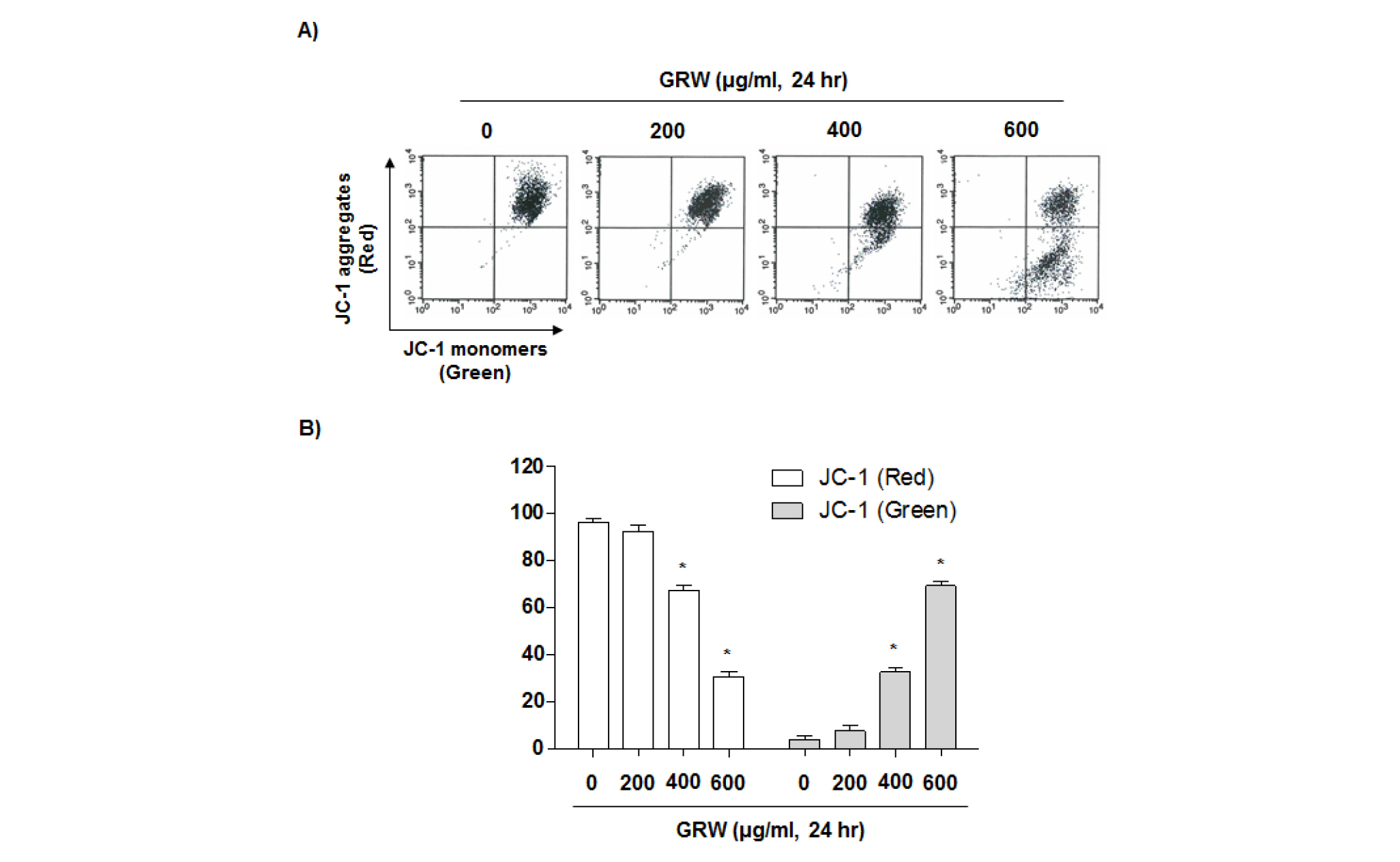
Fig. 4.
Effects of GRW on the MMP values in T24 human bladder cancer cells. (A) Cells were treated with GRW for 24 hr, collected and then incubated with JC-1 (10 μM) for 20 min at 37°C in the dark. The cells were then washed once with PBS and analyzed by a flow cytometer. (B) Results are expressed as percentage of the vehicle treated control ±SD of three separate experiments. Significance was determined using a Student’s t-test (*p<0.05 vs. untreated control).
Caspase의 활성 및 기질 단백질의 발현에 미치는 GRW의 영향
GRW 처리에 의한 방광암 T24 세포에서 apoptosis 유발에 caspase 활성이 관여하는지의 여부를 부가적으로 조사하였다. 먼저 caspases 단백질 발현 정도를 확인한 결과 Fig. 5A에서 나타난 바와 같이 GRW 처리에 의하여 불활성형인 pro-caspase-3, -8 및 -9 단백질의 발현은 감소하는 것으로 나타났으나 활성형 단백질 발현은 나타나지 않았다. 따라서 in vitro caspases activity assay를 통하여 이들 caspases의 활성 정도를 정량적으로 분석한 결과, Fig. 5B에서 나타난 바와 같이 caspase-3, -8 및 -9의 활성이 GRW 처리 농도 의존적으로 증가하여 최고 농도인 600 ㎍/mL 처리군에서 각각 4.6배, 4.8배 및 5.1배 증가하는 것으로 나타났다. 정상적인 세포에서 핵과 미토콘드리아 외막에 불활성 형태인 proenzyme 형태로 존재하는 caspases는 caspase-8 및 –9과 같은 initiator caspase와 caspase-3, -6 및 -7과 같은 effector caspase로 구분되며, 다양한 세포 내/외부 자극에 의하여 initiator caspases가 활성화되면 하위단계에 존재하는 effector caspases가 활성화되어 여러 종류의 기질 단백질들을 분해함으로써 apoptosis를 유발하는 것으로 알려져 있다(Fiandalo and Kyprianou, 2012; Lee et al., 2018). 다음으로 활성화된 caspase-3에 의하여 특이하게 분해가 일어나는 기질 단백질 발현에 미치는 GRW의 영향을 조사한 결과 Fig. 5A에서 PARP의 발현 감소 및 단편화 현상이 관찰되었다. Caspases 활성화에 의하여 분해가 유발되는 대표적인 기질 단백질로는 PARP가 알려져 있으며, DNA의 결함을 인지하는 domain을 가지고 있어 DNA 수선에 관여함으로써 세포의 유전적 안정성 유지에 중요한 역할을 하지만 분해가 유발되면 DNA 수선 기능을 상실하게 되는 것으로 알려져 있다(Yinjun et al., 2004). 이상의 결과를 살펴볼 때 인체 방광암 T24 세포에서 GRW이 유발하는 apoptosis는 caspase-8 및 -9의 활성화에 따른 caspase-3의 활성화 및 기질단백질인 PARP의 단편화가 중요한 역할을 한다는 것을 알 수 있었다.
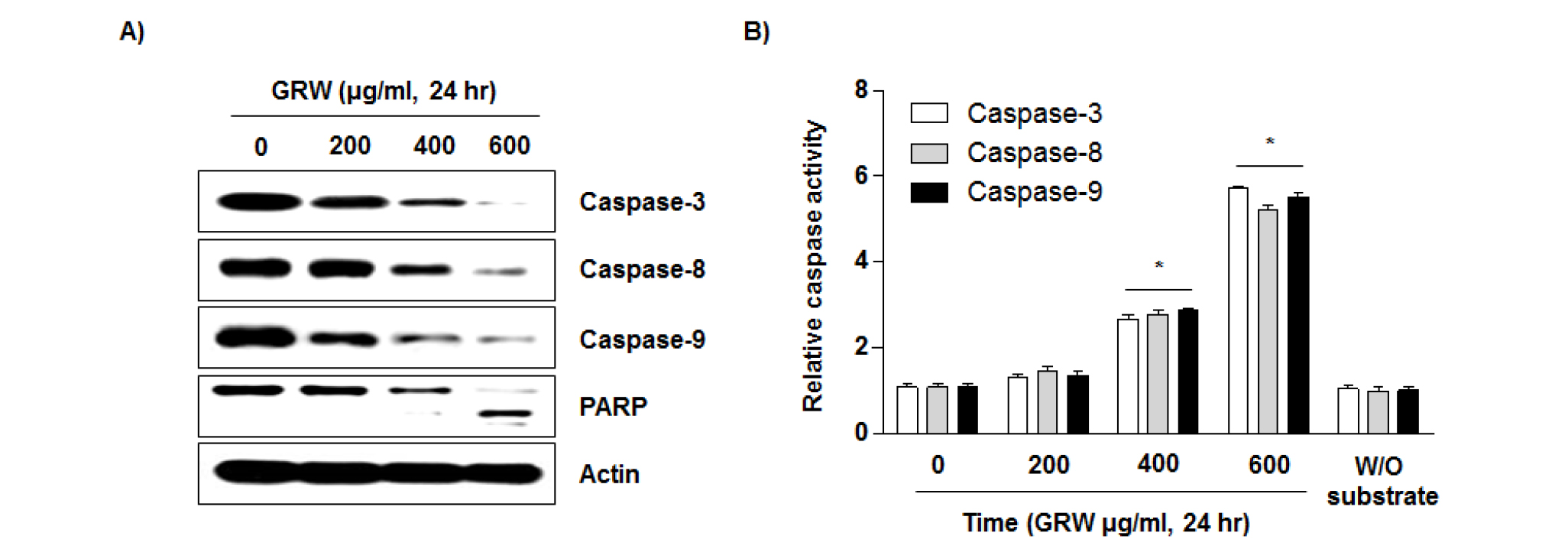
Fig. 5.
Activation of caspases and the degradation of the caspase-3 substrate protein by GRW treatment in T24 human bladder cancer cells. The cells were treated with indicated concentration of GRW for 24 hr. (A) The cells were lysed and then equal amounts of cell lysates were separated on SDS-polyacrylamide gels and transferred to nitrocellulose membranes. The membranes were probed with the indicated antibodies. Proteins were visualized using an ECL detection system. Actin was used as an internal control. (B) Caspases (-3, -8, and -9) activities were determined using in vitro caspases assay kits obtained from R&D according to the protocol of the manufacturer. The data are expressed as the mean ±SD of three independent experiments. The significance was determined by the Student’s t-test (*p<0.05 vs. untreated control).
적요
본 연구에서는 다양한 약리학적 활성을 가지는 것으로 알려진 감초 열수추출물(GRW)의 항암효능을 알아보기 위하여 인체 방광암 T24 세포에서 생존율 및 증식억제에 미치는 영향과 이와 연관된 apoptosis 유발 여부 및 관련 인자들의 발현 변화를 조사하였다. 먼저 GRW의 처리에 따른 증식억제 정도를 조사한 결과, GRW 처리 농도 의존적으로 생존율 및 증식억제 현상이 나타났으며, 핵의 형태 변화, DNA 단편화 및 apoptosis 유발에 관하여 조사한 결과 역시 GRW 처리 농도 의존적으로 증가됨을 확인할 수 있었다. 이는 GRW의 처리에 의한 암세포의 증식억제 및 형태적 변형이 암세포의 apoptosis 유발과 밀접한 관련이 있음을 시사하여 주는 것으로 사료된다.
GRW 처리에 의한 apoptosis 유발에 관여하는 유전자의 탐색을 위하여 apoptosis와 연관성을 가지는 Bcl-2 family에 속하는 유전자의 발현을 조사한 결과 GRW 처리 농도 의존적으로 Bax 단백질의 발현증가와 더불어 Bcl-2 및 Bcl-xL 단백질의 발현감소가 관찰되었다(Fig. 3A). 이는 GRW에 의한 T24 세포의 apoptosis 유발에 Bcl-2 family에 속하는 유전자의 발현 조절이 중요한 역할을 하는 것으로 사료된다. 또한 GRW의 처리에 따른 MMP의 소실은 미트콘드리아 막의 교란이 유발되었음을 의미하는 것으로, 이러한 MMP 값의 변동은 Bcl-2 family 단백질의 발현 변화에 의한 것이라 추정된다. 한편 Apoptosis에 중요한 역할을 하는 것으로 알려진 caspase(-3/-8/–9)의 발현과 이들의 활성을 억제하는 IAP family (XIAP, cIAP-1, cIAP-2)의 발현에 GRW이 어떠한 영향을 미치는지를 조사한 결과, caspase-3, -8 및 -9의 활성형 단백질 발현 및 정량적 활성증가를 확인하였으며, IAP family 속한 3가지 단백질 모두 발현이 감소하는 것이 관찰되었다.
이상의 결과에서 GRW은 외인적 및 내인적 경로의 개시에 핵심적인 역할을 하는 caspase-8 및 -9의 활성을 모두 증가시켰으며, 이에 따른 caspase-3의 활성증가에 의하여 apoptosis가 유발되었음을 알 수 있었다. 이러한 두 경로의 동시 활성화에는 미트콘드리아의 기능 소실과 Bcl-2 및 IAP family의 발현 변화가 관여하고 있었으며, 특히 Bid의 발현 감소는 GRW에 의한 내인적 경로를 증폭시키는 효과로 작용했을 것이라 추정된다. 방광암의 치료에 보다 효과적인 생리활성을 갖는 물질을 발굴하고 그와 관련된 분자 및 세포수준에서의 기전을 밝히는 것이 중요하기에 본 연구의 결과는 향후 GRW로 수행될 추가 실험을 위한 기초자료로서 그 가치가 매우 높을 것으로 사료된다.




