서 언
재료 및 방법
시약
실험재료 및 시료준비
총 폴리페놀 함량(Total polyphenol contents, TPC)
DPPH 라디칼 소거능 측정
ABTS 라디칼 소거능 측정
Ferric ion reducing antioxidant power (FRAP) 측정
환원력(Reducing power, RP) 측정
N-(p-Coumaroyl) serotonin(CS)과N-feruloylserotonin(FS) 함량 측정
통계분석
결과 및 고찰
총 폴리페놀 함량 및 항산화 활성 평가
N-(p-Coumaroyl) serotonin과 N-feruloylserotonin함량
항산화 활성과 세로토닌 유도체의 상관관계 분석
상대적항산화능지수(RACI)
적 요
서 언
급속한 산업화로 인한 환경오염과 생활환경에 따른 식생활 패턴의 변화 등으로 현대인들은 직·간접적으로 산화적 스트레스에 노출되어 있다. 이로 인해 노화, 염증질환, 심장질환, 암 등을 포함하는 다양한 질환이 발생되고 있으며, 인체의 건강한 생리기능을 위해서는 활성산소와 항산화제 간의 균형이 필요하다. 활성산소는 체내에 들어온 산소가 완전히 산화하지 못하고 유리라디칼이라고 하는 불안정한 전자를 생성하게 되며 이들 전자는 다른 원소들과 쉽게 결합할 수 있다(Cheeseman, 1993). 유리라디칼이 인체의 조절하는 능력을 벗어나게 되면 산화스트레스로 알려진 상태를 유지하게 되고, 지질과 단백질 및 DNA의 변화 또는 손상을 일으켜 여러 가지 질환을 유발하는 것으로 알려져 있다(Lobo et al., 2010). 항산화제의 공급은 이러한 산화스트레스에 대처할 수 있다. 과거에는 경제성과 항산화제로서 탁월한 효과의 이유로 합성항산화제인 BHA (butylated hydroxyanisole)와 BHT (butylated hydroxytoluene)의 사용이 일반적이었으나 과다 사용시 독성을 나타내는 등 안정성의 문제로 현재는 사용량이 법적으로 규제되어 있는 실정이다(Branen, 1975; Ito et al., 1983). 이에 반해, 천연항산화제는 tocopherol, phenol 화합물 등의 천연물질로 이루어져 있으며, 기존의 합성항산화제가 지니는 안정성에 있어서는 뛰어나지만, 가격이 비싸고 항산화 효능이 비교적 낮다는 단점이 있다(Perron and Brumaghim, 2009). 따라서 뛰어난 안정성과 항산화 효능을 지닌 천연항산화제의 소재 발굴에 대한 연구가 활발히 진행되고 있다(Jang et al., 2016; Nho et al., 2018; Yu and Moon, 2018). 홍화는 잇꽃이라고 불리며, 국화과에 속하는 일년생 초본으로 이집트 및 아프가니스탄, 이란 이라크 등 중동지역이 원산지로 알려져 있다. 다목적 작물인 홍화는 오랜 재배 역사를 가진 작물 중 하나이며, 식품의 착색염료 등 천연 염료와 혈액과 심장, 자궁, 비뇨기 등 약재로 사용되고, 다량의 지방을 함유하고 있어 식용유 및 산업용 오일로 이용된다(Choi et al., 2011). 홍화의 대표적인 성분으로는 색소성분인 Carthamin과 Safflor Yellow, 기름성분인 Fatty acid (oleic acid, linoleic acid)이 대표적이다. 그리고 세로토닌 유도체는 탈지된 홍화 종자의 주된 성분이며, 독특한 페놀성분으로 확인되었고, N-feruloylserotonin (FS)는 강력한 항산화 활성을 가지는 것으로 보고되었다(Baek et al., 1999; Sakamura et al., 1978; Song et al., 2000). 이러한 생리활성물질들은 항산화 활성과 항염증 효과, 암 예방 및 항암 효과를 가지는 것을 보고되었다(Bae et al., 2002; Kim et al., 2003; Kim et al., 2013; Lee et al., 2014a). 또한, 전뇌허혈에 대한 신경보호 효과(Wei et al., 2005; Kim et al., 2014), α-glucosidase 억제를 통한 항당뇨 효과(Takahashi and Miyazawa, 2012), 지방세포분화 억제 효과(Yu et al., 2013), 항불안성과 항우울성 효과(Qazi et al., 2015), 알츠하이머병 치료를 위한 acetylcholinesterase 억제 효과(Peng et al., 2017) 등의 연구가 이루어져 있다. 홍화는 전세계적으로 널리 분포하고 있으나, 국가 또는 지역 간의 항산화 활성과 성분의 함량을 비교할 수 있는 기초연구자료는 미흡하였다. 본 연구에 사용된 아프가니스탄, 이란, 이라크, 이스라엘, 요르단은 홍화의 기원 및 원산지이다. 따라서 5 개국의 홍화 종자를 대상으로 항산화 활성 및 세로토닌 유도체 함량을 비교하여 국가별 차이를 알아보고, 항산화능이 높은 자원을 선발하여, 새로운 천연항산화제 개발을 위한 식물 소재와 유용정보로 제공하고자 한다.
재료 및 방법
시약
항산화 실험에 사용된 시약과 표준물질은Folin-Ciocalteu reagent, 2,2-diphenyl-1-picryl-hydrazil(DPPH), 2,2'-azino-bis (3-ethylbenzothiazoline-6-sulphonic acid) diammonium salt (ABTS), sodium acetate, acetic acid, 2,4,6-tripyridyl-s-triazine (TPTZ), HCl, iron(III) chloride hexahydrate, potassium hexacyanoferrate(III), trichloroacetic acid (TCA), sodium phosphate dibasic, sodium phosphate monobasic monohydrate, L-ascorbic acid, gallic acid이며, 모든 시약은 analytic grade로 Sigma Aldrich (St. Louis, MO, USA)에서 구입하였다. 세로토닌 유도체 정량분석에 사용된 표준물질은 N-(p-Coumaroyl) serotonin과 N-feruloylserotonin 이며, Santa Cruz Biotechnology, Inc. (Santa Cruz, CA, USA)에서 구입하였다.
실험재료 및 시료준비
본 연구에 사용된 홍화 종자는 농촌진흥청 국립농업과학원 농업유전자원센터에 분양 받아 이용하였다. 분양 받은 자원은 2017년 전라북도 전주 시험포장에서 재배하여 실험재료로 활용하였다. 항산화 활성 실험과 CS의ㅋ FS함량분석에 사용된 시료는 거칠게 분쇄한 종자에 헥산을 가해 유분을 제거하고 건조시킨 후, 7 g을 고속용매추출장치 ASE 200 (Dionex, Sunnyvale, California, USA)를 이용하여 추출하였으며, 추출조건은 질소가스 1,200 psi, 70℃이며, 용매는 75% 에탄올을 사용하였다. 추출된 시료는 진공원심농축기 HT-4 (Genevac, Ipswich, Suffolk IP1, 5AP, UK)를 이용하여 40℃에서 10시간 동안 농축하였다. 농축된 시료는 항산화 실험에 사용하기 위해 0.1 ㎎/mL로 희석하였고, 성분분석을 위한 시료는 0.5 ㎎/mL으로 희석하여 0.45 ㎛ 실린지 필터로 여과하여 준비하였다.
총 폴리페놀 함량(Total polyphenol contents, TPC)
총 폴리페놀 함량은 Folin-Ciocalteu방법을 참고하여 측정하였다(Waterhouse, 2002). 96well plate에 시료 100 μL에 1N Folin & Ciocalteu’phenol 100 μL를 첨가하여 호일을 덮고 3분간 실온에서 보관하였다. 이후 2% sodium carbonate (Na₂CO2) 100 μL를 첨가한 뒤 호일을 덮고 30분간 실온에서 반응 후 마이크로플레이트 분광광도계(Eon, Bio-tek, USA)를 이용하여 750㎚에서 흡광도를 측정하였다. 표준물질은gallic acid를 사용하여 측정된 값을 환산하여 비교하였다.
DPPH 라디칼 소거능 측정
DPPH 의한 유리라디칼 소거능은 수소 공여능을 측정할 수 있는Piao et al. (2013)의 방법을 변형하여 측정하였다. 96well plate에 시료 100 μL에 150 μM DPPH 용액 150 μL를 첨가하여 호일로 빛을 차단 후, 30분간 실온에 반응시킨 뒤 마이크로플레이트 분광광도계(Eon, Bio-tek, USA)를 이용하여 517 ㎚에서 흡광도를 측정하였다. 표준물질은ascorbic acid를 사용하였고, DPPH 라디칼 소거능은 다음식을 이용하여 계산하였다.
DPPH radical scavenging activity = 1 - (A sample – A sample blank) / (A control – A control blank)
ABTS 라디칼 소거능 측정
ABTS 라디칼 소거능은 Re et al. (1999)의 방법을 응용하여 평가하였다. ABTS 용액 7 mM ABTS와 2.45 mM potassimpersulphate를 각각 제조하여 섞어 12시간 이상 빛을 차단하여 냉장 보관하였다. 양이온(ABTS+)을 생성시킨 후, 734 ㎚에서 흡광도 값의 범위가 0.70±0.02가 되게 희석하였다. 96well plate에 시료 10 μL에 준비된 ABTS 용액 190 μL를 첨가하여 호일로 빛을 차단 후, 30분 실온에서 반응시킨 뒤 마이크로플레이트 분광광계도 (Eon, Bio-tek, USA)를 이용하여 734 ㎚에서 흡광도를 측정하였다. 표준물질은 ascorbic acid를 사용하였고, ABTS 라디칼 소거능은 다음 식을 이용하여 계산하였다.
ABTS radical scavenging activity = 1 - (A sample – A sample blank) / (A control – A control blank)
Ferric ion reducing antioxidant power (FRAP) 측정
산화 및 환원 반응을 측정하는 FRAP 활성은 Benzie and Strain (1996)의 방법을 변형하여 측정하였다. FRAP 용액은 0.1M acetate buffer (pH 3.6), 10mM TPTZ/40mM HCl, 20mM Ferric chloride solution (FeCl3·6H2O)을 10:1:1의 비율로 각각 제조하여 혼합하고 37℃에 보관하였다. 96well plate에 시료 10 μL과 준비한 FRAP용액 300 μL를 혼합한 후, 호일로 빛을 차단하였다. 37℃에서 30분간 반응시킨 후, 마이크로플레이트 분광광도계(Eon, Bio-tek, USA)를 이용하여 593 ㎚로 흡광도를 측정하였다. 표준물질은 ascorbic acid을 사용하였고, 측정값은 ascorbic acid equivalent 농도로 환산하여 비교하였다.
환원력(Reducing power, RP) 측정
RP는 Yen and Chen (1995)의 방법을 참고하여 측정하였다. 시료 60 μL과 0.2M phosphate buffer (pH 6.6) 150 μL과 1% K3Fe(CN)6 150 μL를 혼합하여, 50℃에서 20분 동안 반응시킨 뒤, 10% Trichloroacetic acid 150 μL를 첨가하여 13000 rpm으로 10분 동안 원심분리 하였다. 96well plate에 상등액 100 μL, 3차 증류수 100 μL, 0.1% Ferric chloride 20 μL를 분주한 후, 호일로 빛을 차단하여, 상온에서 10분간 반응 후 마이크로플레이트 분광광도계(Eon, Bio-tek, USA)를 이용하여 700 ㎚로 흡광도를 측정하였다. 표준물질은 ascorbic acid을 사용하였고, 측정값은 ascorbic acid equivalent 농도로 환산하여 비교하였다.
N-(p-Coumaroyl) serotonin(CS)과N-feruloylserotonin(FS) 함량 측정
시료의CS과FS의 함량은 Ultra High Performance Liquid Chromatography (UHPLC, Agilent 1290 Infinity Ⅱ, USA)를 이용하여 측정하였으며, 분석조건은 다음과 같다(Table 1).
Table 1. Conditions of UHPLC for identification and determination of CS and FS
통계분석
모든 실험은 한 시료당 3반복 분석하였으며, 결과는 R Project (www.r-project.org, R i386 3.5.2, Vienna, Austria)를 이용하여 통계분석 하였고, 통계적 유의성은 p<0.05의 수준에서 검정하였다.
결과 및 고찰
총 폴리페놀 함량 및 항산화 활성 평가
이란 등 5개국에서 수집한 홍화 유전자원을 대상으로 총 폴리페놀 함량과 항산화 활성을 측정한 결과는 Table 2와 Table 3에 나타내었다. Phenolic hydroxyl을 가지는 페놀성 화합물은 2차 대사산물의 하나로 단백질 및 기타 거대분자들과 쉽게 결합하며, 항산화 효과와 같은 생리활성은 질병의 예방과 회복에 도움을 주는 역할을 한다(Kumar et al., 2006). TPC 분석 결과, 28.25에서 90.53 ㎍ gallic acid equivalent (GAE)/㎎ dried extract (DE)의 함량으로 넓은 범위로 분포하였으며, 평균 55.08 ㎍ GAE/㎎ DE의 값으로 나타났다. 국가별 TPC의 평균은 이란이 61.69 ㎍ GAE/㎎ DE로 가장 높았고, 아프가니스탄 54.91 ㎍ GAE/㎎ DE, 이스라엘 51.14 ㎍ GAE/㎎ DE, 요르단 46.81 ㎍ GAE/㎎ DE, 이라크 35.24 ㎍ GAE/㎎ DE의 순으로 나타났다. 대조품종으로 사용된 의산홍화와 청수홍화의 값은 61.90와 54.45 ㎍ GAE/㎎ DE으로 측정되었다. 국가 간의 TPC를 비교해보면, 아프가니스탄과 이란은 이라크와 이스라엘, 요르단과 유의한 차이가 나타났다(p<0.05). Sung et al.(2018)의 연구에 따르면, 중국과 일본, 한국, 북한에서 수집한 홍화 유전자원의 TPC는 68, 58, 62 및 70 ㎍ GAE/㎎로 조사되었고, 본 연구에 사용된 지역과 비교하였을 때, 동아시아 지역의 홍화 유전자원에서 페놀함량이 높게 나타났다. 실험방법이 같은 본 연구와 선행연구의 지역간TPC 차이는 홍화 유전자원이 지닌 유전자형에서 영향을 받았을 것이라 생각한다. 또한 Mujic et al. (2011)는 두 지역에서 수집된 콩에서 TPC가 지역 간에 통계적으로 유의한 차이가 있었다고 보고하였다.
Table 2. Antioxidant activity, total phenolic contents, and contents of selected individual CS and FS of safflower germplasm collected from 5 countries in south asia
yCS : N-(p-Coumaroyl) serotonin, ㎎/g DE, xFS : N-feruloylserotonin, ㎎/g DE, wTPC : total polyphenol content, ㎍ GAE/㎎ DE, vABTS : ABTS radical scavenging activity, ㎍ ASCE/㎎ DE, uDPPH : DPPH radical scavenging activity, ㎍ ASCE/㎎ DE, tFRAP : ferric reducing antioxidant power, ㎍ ASCE/㎎ DE, sRP : reducing power, ㎍ ASCE/㎎ DE,
The component and antioxidant activity values were expressed as the mean and standard deviation of three replicates.
Table 3. ANOVA on serotonin derivatives and antioxidant activity between collection sites
항산화 활성 평가를 위해 다양한in vitro항산화 실험을 수행하였다. 일반적으로 가장 많이 이용되는 DPPH assay와 ABTS assay는 색소화합물인 DPPH 라디칼과 ABTS+을 이용한 유리라디칼 소거능을 측정하는 것이며(Arnao, 2000), FRAP assay 과 RP assay는 산화 및 환원반응을 측정하는 방법으로, 시료의 환원능을 평가하는 것이다. 이란 등 5개국에서 수집한 홍화 유전자원의 DPPH 라디칼 소거능은 18.76에서 93.98 ㎍ ascorbic acid equivalent (ASCE)/㎎ dried extract (DE)의 범위였으며, 국가별 평균값은 이란이 57.56 ㎍ ASCE/㎎ DE으로 가장 높은 값을 가졌고, 아프가니스탄 51,84 ㎍ ASCE/㎎ DE, 이스라엘 38.06 ㎍ ASCE/㎎ DE, 요르단 35.81 ㎍ ASCE/㎎ DE, 이라크 18.76 ㎍ ASCE/㎎ DE의 순으로 나타났다. 대조로 사용된 의산홍화와 청수홍화는 59.05 및 52.81 ㎍ ASCE/㎎ DE의 값을 나타내었으며, 요르단과 이스라엘, 이라크와 유의한 차이를 보였다(p<0.05). ABTS는 Potassium persulfate와의 반응에 의해 생성되는 ABTS 유리라디칼이 시료의 항산화 물질에 의해 제거되어 라디칼 특유의 색상이 탈색되는 것을 측정하는 것으로 DPPH assay와 라디칼 소거능을 측정하는 점은 같으나 다른 점은 화학반응을 통해 발생된 유리라디칼 용액에 시료를 넣어 항산화능을 측정한다는 점이다(Yoo et al., 2007). 국가별 ABTS 라디칼 소거능의 결과는 48.91 ~ 163.73 ㎍ ASCE/㎎ DE의 범위이며, 국가별 평균값은 이란이 113.75 ㎍ ASCE/㎎ DE로 가장 높은 값을 나타났고, 아프가니스탄 102.59 ㎍ ASCE/㎎ DE, 이스라엘 72.95 ㎍ ASCE/㎎ DE, 요르단 69.67 ㎍ ASCE/㎎ DE, 이라크 61.43 ㎍ ASCE/㎎ DE의 값을 가졌다. 대조로 사용한 의산홍화와 청수홍화는 131.46 및 138.74 ㎍ ASCE/㎎ DE의 값으로 측정되었고, 국가 간의 유의한 차이를 보였다(p<0.05). 동아시아 잇꽃 유전자원의 항산화 분석 결과에 따르면, DPPH와 ABTS의 평균값은 4.6 ㎍ ASC/㎎와 72.2 ㎍ ASC/㎎로 보고되었는데(Sung et al., 2018), 본 연구대상자원의 DPPH 및 ABTS평균값이 훨씬 높았다. 특히 DPPH 평균값이 10배이상 높게 나타났다. FRAP 활성은 pH 3.6의 조건에서 시료의 항산화제로부터 ferric tripyridyltrizaine복합체가 ferrous tripyridyltriazine으로 환원되는 것을 측정하는 것이다(Benzie and Strain, 1996). 측정된 FRAP 값은 3.80 ~ 132.29 ㎍ ASCE/㎎ DE로 다소 넓은 범위를 보였다. 국가별 평균값은 이란이 80.40 ㎍ ASCE/㎎ DE으로 높았고, 요르단 69.90 ㎍ ASCE/㎎ DE, 이스라엘 57.72 ㎍ ASCE/㎎ DE, 아프가니스탄 40.14 ㎍ ASCE/㎎ DE, 이라크 34.03 ㎍ ASCE/㎎ DE의 순으로 측정되었다. 대조품종인 의산홍화와 청수홍화는 124.96과 128.96 ㎍ ASCE/㎎ DE로 측정값이 가장 높은 이란보다 높게 측정되어 차이를 보였다(p<0.05). 홍화 유전자원의 RP 측정 결과, 26.32 ~ 80.08 ㎍ ASCE/㎎ DE의 분포를 보였으며, 대조품종인 의산홍화는 65.88 ㎍ ASCE/㎎ DE와 청수홍화는 59.44 ㎍ ASCE/㎎ DE로 측정되었다. 이란 평균값은 53.30 ㎍ ASCE/㎎ DE으로 가장 높았고, 아프가니스탄 51.19 ㎍ ASCE/㎎ DE, 이스라엘 45.93 ㎍ ASCE/㎎ DE, 요르단 43.83 ㎍ ASCE/㎎ DE, 이라크 38.80 ㎍ ASCE/㎎ DE의 순으로 나타났다. 국가간 유의한 차이는 없었다(p<0.05). 4종류의 항산화 활성의 결과는 같은 농도의 시료로 측정했음에도 불구하고 실험마다 측정값의 범위가 달랐다. 이러한 결과는 각 항산화 실험방법에서의 차이로, 반응원리가 다르기 때문으로 생각된다. Lee et al. (2014b)와 Ou et al. (2002)의 보고에 따르면, 항산화 활성 실험마다 반응 메커니즘이 다르고, 시료가 가지는 특정 성분에 대하여 반응 정도가 다르기 때문으로 보고하였고, 이러한 이유로 항산화 활성을 평가할 경우 다양한 실험방법을 권장하고 있다.
N-(p-Coumaroyl) serotonin과 N-feruloylserotonin함량
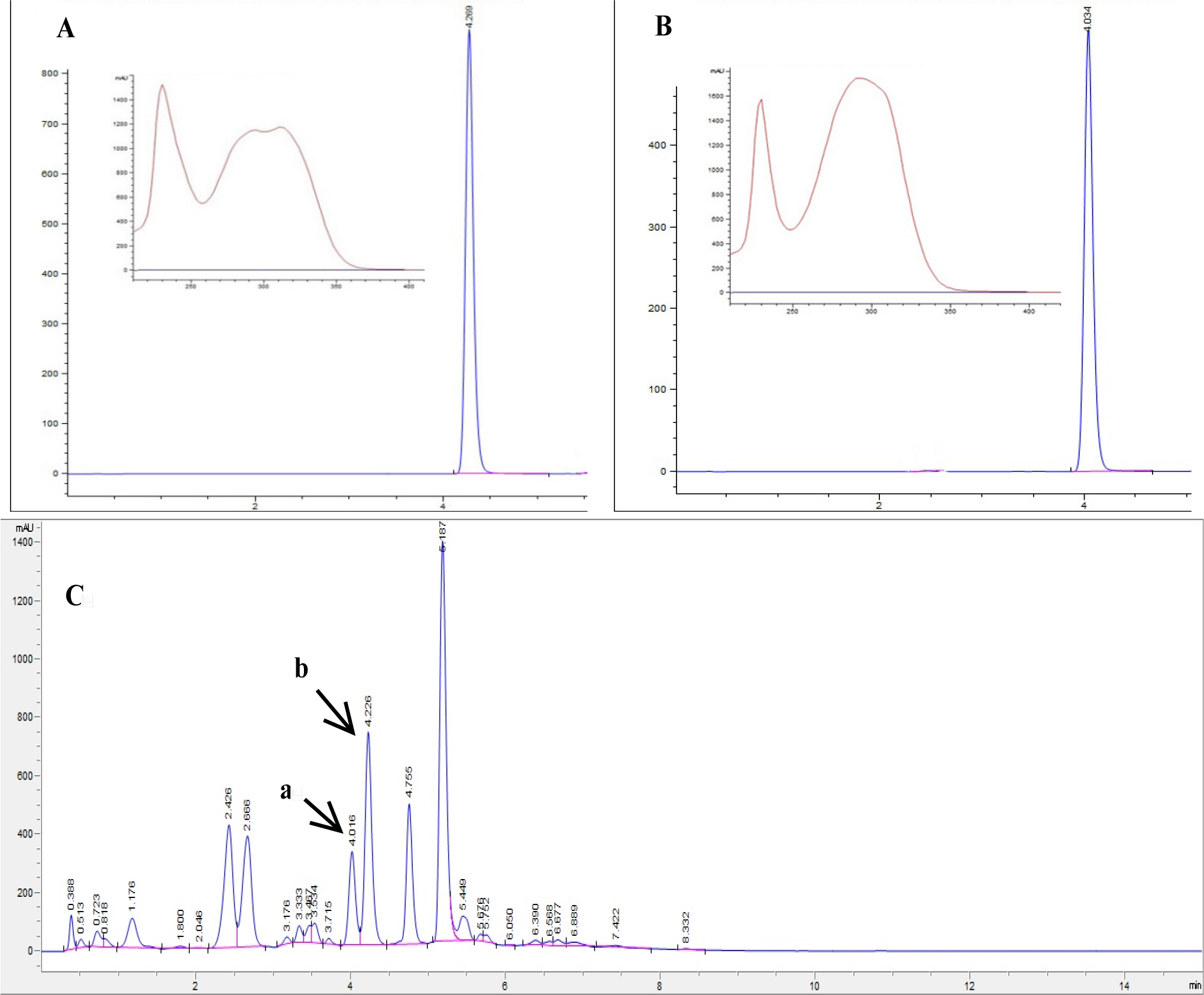
이란 등 5개국의 홍화 유전자원을 대상으로CS와FS을 측정한 결과는 다음과 같다(Table 2). UHPLC를 이용하여 분석한 결과, CS와 FS는 각 4.06분과 4.25분에서 검출되었다(Fig. 1). CS 함량의 범위는 2.56 ~ 64.99 ㎎/g DE으로 측정되었고, 평균함량은 24.94 ㎎/g DE이었다. 국가별 함량은 이란 37.66 ㎎/g DE, 아프가니스탄 26.26 ㎎/g DE, 이스라엘 13.30 ㎎/g DE, 요르단 10.40 ㎎/g DE 및 이라크 2.56 ㎎/g DE으로 나타났다. 의산홍화와 청수홍화는 21.43, 14.11 ㎎/g DE으로 측정되었다. FS 함량 평균은 23.37 ㎎/g DE이고, 1.92 ~ 65.36 ㎎/g DE의 범위를 보였다. 대조품종으로 사용된 의산홍화와 청수홍화의 FS 함량은 각각 19.50 및 16.98 ㎎/g DE이었다. 세로토닌 유도체 함량은 이란이 가장 높았고, 아프가니스탄, 이스라엘, 요르단, 이라크 순이었으며, 국가간 함량의 유의한 차이가 있었으며, 이스라엘과 요르단은 함량의 차이가 없었다(p<0.05). 이는 각 홍화 유전자원의 유전자형과 수집지의 토양, 기온 등의 차이가 페놀화합물을 생성하는데 영향을 미쳤을 것이라 생각된다. Kim et al. (2008)에 의하면 홍화종자의 페놀화합물 함량의 차이는 품종, 재배 및 수확시기에 따라 달라질 수 있으며, 발아함에 따라 세로토닌 유도체 함량은 감소한다고 보고하였다.
항산화 활성과 세로토닌 유도체의 상관관계 분석
이란 등 5개국에서 수집한 홍화 유전자원의 항산화 활성과 세로토닌 유도체 함량 간의 상관관계는 Table 4와 같다. CS와 FS는 FRAP를 제외한 항산화 활성과 상관성이 나타났다. CS는 TPC와 ABTS, DPPH와 높은 상관성을 보였고(r=0.673, 0.727, 0.820), FS는 DPPH와 높은 상관성을 보였다(r=0.740). 본 연구에서는 2가지 성분과 항산화 활성 사이의 상관관계를 분석하였다. CS와 FS 사이에서는 높은 양의 상관관계를 확인하였고(r=0.838), TPC는 DPPH, ABTS와 양의 상관관계를 보였으나(r=0.821, 0.903), FRAP와 RP와는 유의한 상관관계는 없었다. 세로토닌 유도체는 홍화 종자의 성분 중에서 독특한 페놀 성분으로 indole hydroxycinnamic acid amides 그룹에 포함된다. 세로토닌 유도체는 자유 라디컬 생성 시스템에 의해 유도된 LDL 산화를 억제한다고 보고하였으며(Cho et al., 2006; Koyama et al. 2006), 홍화에서 분리된 세로토닌 유도체의 항산화 효과는 NO와 관련 있는 허혈-재관류 심장에서 중요한 역할을 한다는 것을 보고하였다(Hotta et al. 2002). Zhang et al. (1997)는 홍화 유박에서 세로토닌 유도체를 분리하여 DPPH 라디컬 소거능을 통하여, 세로토닌 유도체가 비교적 강한 항산화 활성을 갖는 것으로 보고하였고, 또한 세로토닌 유도체와 항산화 활성 관계에서 유리 5-OH를 갖는 세로토닌 부분이 주로 기여한다고 보고하였다. 이처럼 항산화 활성과 세로토닌 유도체는 강한 상관관계가 있음을 확인할 수 있으며, 나아가 홍화 종자의 세로토닌 유도체를 활용한 기능성 소재로써 정보를 제공할 수 있을 것이다.
Table 4. Pearson correlation coefficients for ingredients of serotonin derivatives and antioxidant activity
상대적항산화능지수(RACI)
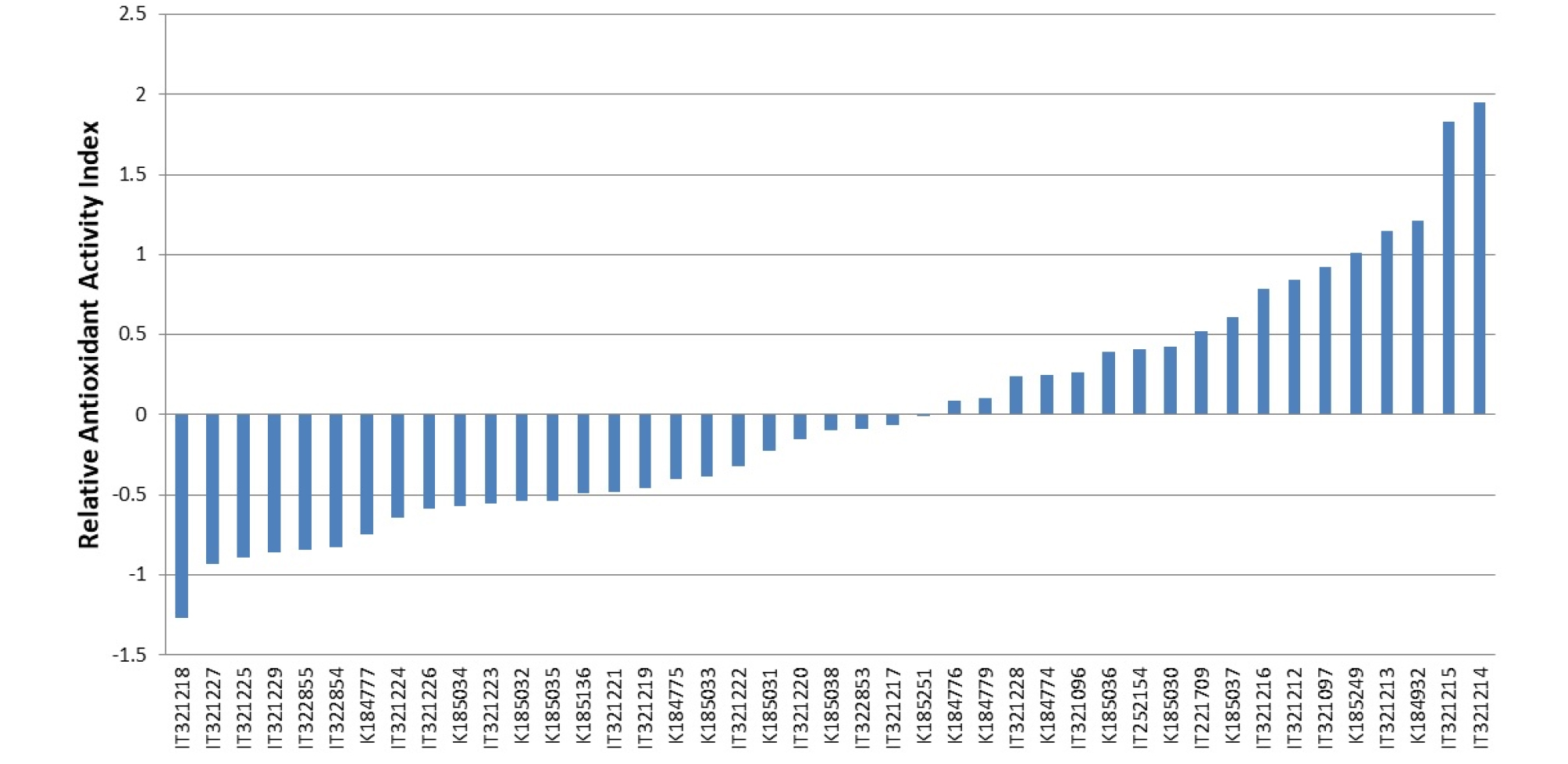
상대적항산화능지수(Relative antioxidant capacity index, RACI)는 상대 지수이며, 여러 가지의 화학적 방법으로 얻은 항산화능을 비교할 수 있다(Sun and Tanumihardjo, 2007). 이란 등 5개국에서 수집한 홍화 유전자원의 세로토닌 유도체 함량과 항산화 활성 평가로 얻은 결과를 통합하여 RACI를 계산한 결과는 Fig. 2와 같다. RACI가 가장 높은 자원은 IT321214(1.95)과 IT321215(1.83)이며, IT321218(-1.26)과 IT321227(-0.93)은 가장 낮은 RACI 값을 나타내었다. 대조품종으로 사용된 의산홍화와 청수홍화는 각 0.52 와 0.41의 값을 나타내었다. 홍화 유전자원으로 세로토닌 유도체 함량과 5가지 항산화 활성을 평가하여 RACI를 분석한 결과, 항산화 활성이 높은 IT321214과 IT321215 자원은 천연항산화제 소재 탐색 및 개발에 기초자료로 활용할 수 있을 것으로 사료된다.
적 요
본 연구는 이란 등 5개국에서 수집한 홍화자원을 대상으로하여 천연항산화제로써 홍화종자의 항산화 활성을 평가하고, 세로토닌 유도체인N-(p-Coumaroyl) serotonin과N-feruloylserotonin의 함량을 측정하여 항산화 활성과의 상관관계를 조사하였다. 총폴리페놀함량은 28.25 ~ 90.53 ㎍ GAE/㎎ DE의 범위를 나타내었고, 색소화합물인 DPPH 라디칼과ABTS+을 이용한 유리라디칼소거능을 측정하는 DPPH assay와 ABTS assay의 값은 18.76 ~ 93.98 및 48.91 ~ 163.73 ㎍ ASCE/㎎ DE의 범위를 나타내었다. 시료의 환원능을 측정하는 방법인 FRAP assay과 RP assay는 3.80 ~ 132.29 및 26.32 ~ 80.08 ㎍ ASCE/㎎ DE의 범위로 나타내었다. UHPLC를 이용하여 CS와 FS를 분석한 결과, CS 함량은 2.56 ~ 64.99 ㎎/g DE이고, FS 함량값은 1.92 ~ 65.36 ㎎/g DE이었다. 5개국 중 이란 원산종은 다른 나라에 비해 세로토닌 유도체 함량과 항산화 활성의 평균값이 높게 측정되었다. 항산화 활성과 세로토닌 유도체 함량간의 상관관계 분석 결과, CS는 TPC와 ABTS, DPPH와 높은 상관성을 보였고(r = 0.673, 0.727, 0.820), FS는 DPPH와 높은 상관성을 보였다(r = 0.740). RACI를 통하여 선발된 IT321214과 IT321215는 항산화 활성이 높은 자원으로 천연항산화제 소재 탐색 및 개발에 기초자료로 활용할 수 있을 것으로 생각된다.