서언
재료 및 방법
실험재료 및 추출물 조제
시약 및 기기
세포배양
세포 생존율 측정
Nitric oxide (NO) 및 PGE2의 측정
Cytokine (IL-1β, IL-6, TNF-α) 측정
정량 중합 효소 반응 real-time reverse transcription polymerase chain reaction (RT-PCR)
Western blot analysis
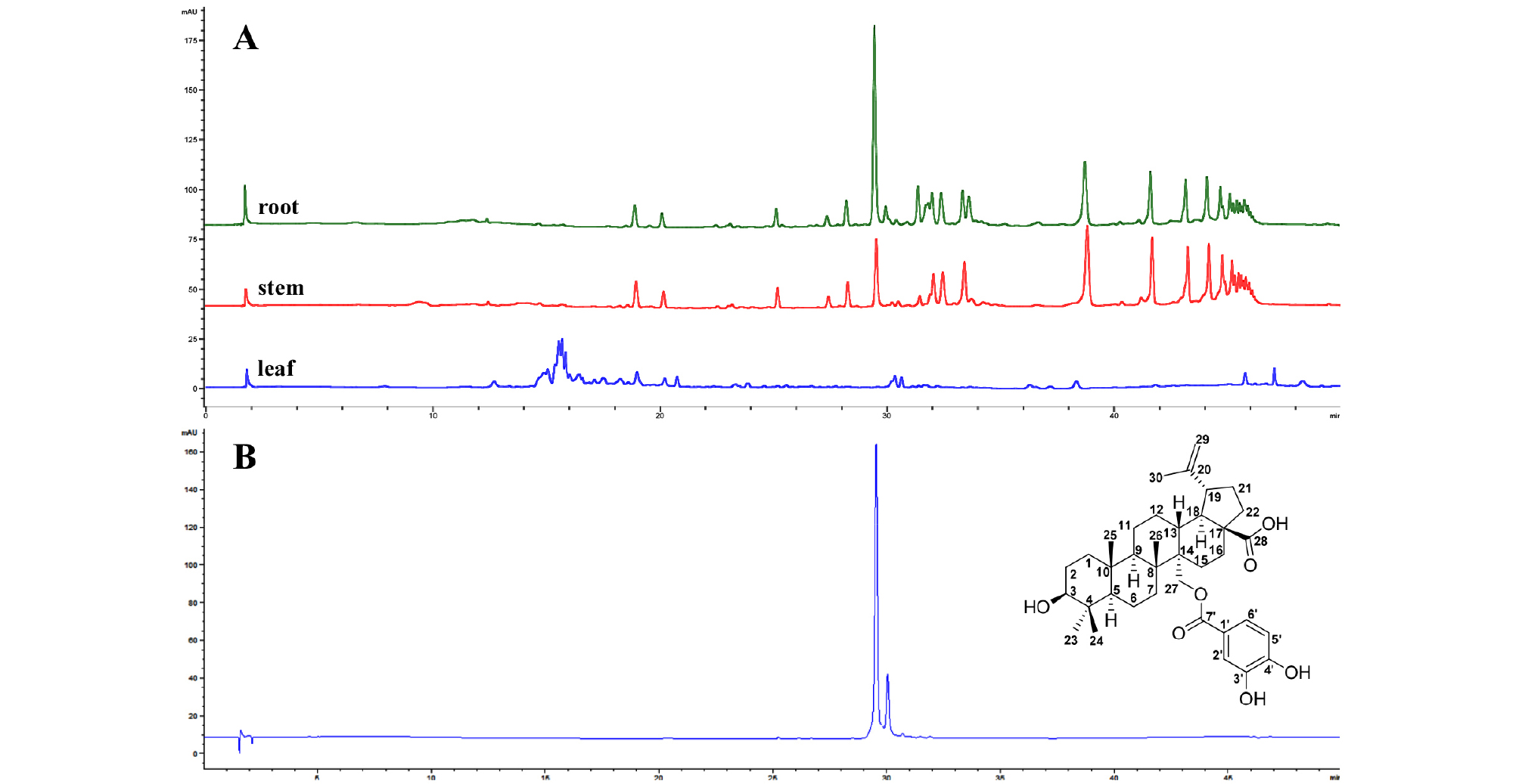
부위별 헛개나무 추출물 HPLC 분석
헛개나무뿌리 추출물 활성 성분 분리 및 구조 동정
통계처리
결과 및 고찰
NO, PGE2 생성 및 iNOX, COX-2 발현에 미치는 RE의 효과
전염증성 cytokines 생성과 mRNA 발현에 미치는 RE의 효과
Ik-B 발현량에 미치는 RE의 효과
MAPK 활성에 미치는 RE의 효과
HO-1 발현 유도에 미치는 RE의 효과/ Nrf2 활성에 미치는 HDRE의 효과
헛개나무 부위별 성분분석 및 주요 성분의 구조 동정
적요
서언
대식세포는 염증반응과 면역기능을 조절하며, 항상성을 유지하는데 중요한 역할을 한다. 그람 음성균의 외막 성분인 lipopolysaccharide (LPS)는 대식세포의 감염 초기에 반응하고 숙주 방어에 중추적인 역할을 하나, 과도한 LPS 자극에 의해 활성화된 대식세포는 tumor necrosis factor-α (TNF-α), interleukin (IL)-1β 및 IL-6와 같은 전염성 cytokine을 분비 시키며, nitric oxide (NO), prostaglandin E2 (PGE2) 등의 염증 매개 물질을 다량 분비하게 된다(Jenog et al., 2014). NO는 대식세포가 활성화되면 inducible NO synthase (iNOS)로부터 생산되며, 과도한 NO의 생성은 염증을 유발시키게 되며 병리학적 혈관확장, 세포독성, 조직 손상 등 유해 작용을 일으키는 것으로 알려져 있다(Förstermann and Sessa, 2012). TNF-α, IL-1β 및 IL-6 와 같은 전염증성 cytokine 및 단백질의 유전자 발현은 mitogen-activated protein kinases (MAPKs)와 nuclear factor kappa B (NF-kB)에 의해 조절된다. 면역과 염증 반응에 관계된 유전자의 발현에 있어서 NF-kB가 활성화되면 NF-kB와 결합해 있던 inhibitory kappa B α (IkBα)가 분해되면서 NF-kB가 세포 원형질에서 핵으로 들어가게 되며 이후 TNF-α, IL-6와 같은 cytokine 발현의 전사 인자로서 중요한 역할을 한다(Jang et al., 2005, Majdalawieh and Ro, 2010).
Heme oxygenase (HO)의 대사를 조절하는 효소인 HO-1은 세포의 heme을 분해하여 carbon monoxide (CO), ferrous iron 및 biliverdin으로 전환하게 되고, biliverdin은 다시 환원효소에 의해 bilirubin으로 환원된다(Elbirt and Bonkovsky, 1999). HO-1과 생성된 부산물들은 항염증 및 항세포사멸에 관련된 유전자 발현과 효소의 활성에 영향과 산화적 스트레스로부터 세포와 조직을 보호하는 효소로 인식되고 있다(Gozzelino et al., 2010, Tsan et al., 1989). Bilirubin은 iNOS와 COX-2의 발현 및 NO의 생성을 억제하며 biliverdin은 전염성 cytokine인 IL-6와 IL-1β의 생성을 억제시키는 것으로 보고 되었다. 특히 LPS를 처리한 RAW264.7 세포에서 HO-1은 NO의 생성과 iNOS 유전자 발현을 억제함으로써 항염증 작용을 통하여 세포 손상을 억제한다는 연구 결과가 보고 되었다.
헛개나무(Hovenia dulcis Thunb.)는 갈매나무과의 낙엽활엽교목으로 내한성과 내음성이 강하고 맹아력이 강한 수종으로, 우리나라에서는 설악산, 오대산, 지리산 및 한라산 등에 주로 자라며, 중북부 지방보다는 남쪽 지방에서 잘 생육한다. 헛개나무의 많은 화학성분이 알려졌으며 주요 활성물질로는 saponins 계열의 Hovenoside I-VII, Hovacerboside A1, Hovenidulcioside A1, A2, B1, B2, Hoduloside III등과 Flavonoid 계열의 Quercetin, Kaempferol, (+) Ampelosin, Hovenitin I~III, Hovenodulinol 등이 분리되어 구조가 연구되었다(Park et al., 2015). 지금까지 보고된 약리활성으로 단맛 억제 효과, 간세포 보호 효과, 근육 이완 억제 효과, 이뇨작용, 항산화 작용, 항암작용 및 당뇨 치료 효과 등이 보고되고 있다(Yand et al., 2013). 최근 연구에서는 헛개나무 열매 추출물의 항염증 효능 및 성분 분석에 대한 문헌이 보고되었다(Park et al., 2016).
본 연구에서는 헛개나무 부위별(잎, 줄기, 뿌리) 추출물의 NO 생성 억제효과에서 탁월한 뿌리 추출물의 항염증 효과를 확인하기 위해 NO, PGE2의 생성량과 전염성 cytokine (IL-1β, IL-6, TNF-α) 분비를 측정하였고, 그 조절 기전으로 HO-1과 MAPKs, Ik-Bα를 조사하였다. 또한, 헛개나무뿌리 추출물로부터 유효성분 분리 및 정제하여 분광학적 방법으로 화학 구조 동정에 대한 연구를 진행하고자 하였다.
재료 및 방법
실험재료 및 추출물 조제
본 실험에 사용한 헛개나무 시료는 2017년 8월에 경남 고성군 일대의 야산에서 채취하였으며, 정확히 감정한 후에 음건·세절하여 실험에 사용하였으며, 표본은 국립백두대간수목원 자원식물산업실에 보관하고 있다(PE01708130066). 분쇄된 헛개나무 잎, 줄기, 뿌리 건조 시료 1.5 ㎏을 취하여 10 L 메탄올을 가하여 30℃에서 24시간 추출한 후 원심분리하여 상등액을 1차적으로 회수하고 다시 침전물을 재추출하여 원심분리하여 상등액을 회수하여 1차 상등액과 혼합한 후 감압 농축하여, -20℃의 냉동고에 보관하면서 항염증 효과 및 HPLC 분석을 위한 시료로 사용하였다.
시약 및 기기
Dulbecco’s modified Eagle’s medium (DMEM)과 fetal bovine serum (FBS) 등의 세포배양용 시약들은 Gibco BRL사(Grand Island, NY, USA)에서 구입하였다. Lipopolysaccharide (LPS)와 3’-(4,5-dimethylthiazol-2-yl)-2,5-diphnyltetrazolium bromide (MTT)는 Sigma사(Louis, MO, USA)에서 구입하였다. 96-well tissue culture plates와 기타 tissue culture dishes는 Falcon사 (Corning, NY, USA) 제품을 이용하였다. 실험에 사용된 일차 항체인 iNOS, COX-2, 그리고 Lamin B는 Santa Cruz Biotechnology사 (SantaCruz, CA, USA)에서 구입하였고, p65, phosphor-p65, IκBα, HO-1, Nrf2, phospho-ERK, ERK, phospho-p38, p38, phosphor-JNK, JNK (Cell Signaling, Beverly, MA, USA)에서 구입하였다. 2차 항체인 Horseradish peroxidase (HRP)-conjugated anti-rabbit or goat antibodies는 Jackson ImmunoResearch사(West Grove, PA, USA)에서 구입하였다. Griess Reagent System은 Promega사(Madison, WI, USA)에서 구입하였고, ELISA kit는 R&D systems (Minneapolis, MN, USA)에서 구입하였다.
세포배양
마우스 대식세포주인 RAW264.7 세포는 American Type Culture Collection (ATCC, Manassas, VA, USA)에서 동결 상태로 구입하여 10% feta bovine serum (FBS)과 1% antibiotics (100 U/㎖ penicillin G, 100 ㎍/㎖ streptomycin)을 첨가한 DMEM 배지로 37℃, 5% CO2 환경에서 배양하였다.
세포 생존율 측정
뿌리추출물(RE)의 세포독성 유무를 알아보기 위하여 Cell Counting Kit-8 (Dojindo, Japan)을 이용하여 측정하였다. RAW264.7 세포를 96 well plate에 2x104 cells/㎖로 분주하고 24시간 배양한 다음, 뿌리 추출물(RE)를 농도별(0, 10, 20, 그리고 40 ㎍/㎖)로 처리하여 24시간 배양하였다. 각 well 당 10 ㎕의 CCK-8 용액을 첨가하여 37℃, 5% CO2 조건에서 2시간 반응시킨 후 microplate Reader (BioTek, Winooski, VT, USA)을 이용하여 450 ㎚에서 흡광도를 측정하였다.
Nitric oxide (NO) 및 PGE2의 측정
LPS 자극에 의해 RAW264.7 세포에서 유도된 염증 반응에 대한 각 부위별 추출물의 항염증 효과를 측정하기 위한 일환으로, 세포 배양액 중의 NO를 정량하여 비교하였다. NO 소거 활성을 측정하기 위하여 세포를 96-well plate에 2x104 cells/㎖로 분주하여 24시간 배양한 후 RE을 0, 10, 20, 그리고 40 ㎍/㎖의 농도로 전처리하여 1시간 동안 배양한 후, LPS를 1 ㎍/㎖의 농도로 처리하여 24시간 동안 배양하였다. 배양 상층액 50 ㎕와 동량의 Griess reagent (Promega, Madison, WI, USA)를 혼합하여 반응 시킨 뒤 540 ㎚에서 microplate reader (BioTek, Winooski, VT, USA)를 사용하여 흡광도 값을 측정하였다. Sodium nitrite (NaNO2)의 농도별 표준 곡선을 이용하여 NO값을 산출하였다. 그리고 세포 배양액 내의 PGE2 level은 PGE2 ELISA assay kit (R&D System, Minneapolis, MN, USA)를 사용하여 측정하였다.
Cytokine (IL-1β, IL-6, TNF-α) 측정
NO 측정과 같은 방법으로 세포를 배양한 후, 각 well에서 세포 배양액을 회수하였다. 세포배양 상층액 내의 TNF-α, IL-1β, IL-6 농도는 enzyme linked immunosorbent assay (Elisa) kit (R&D system, MN, USA)를 이용하여 측정하였다.
정량 중합 효소 반응 real-time reverse transcription polymerase chain reaction (RT-PCR)
RAW264.7 세포를 6-well plate에 6x105 cells/㎖로 분주하여 24시간 배양한 뒤 RE을 1시간 동안 처리한 후, LPS를 1 ㎍/㎖의 농도로 24시간 동안 반응하였다. 이후 Trizol (Invitrogen, USA) 시약을 이용하여 total RNA를 분리하였다. Total RNA를 정량하고, RT-PreMix (Promega, Madison, WI, USA)를 이용하여 1 ㎍의 각 total RNA로부터 각각의 cDNA를 합성하였다. 각 cDNA의 template와 iNOS, COX-2, IL-6, IL-1β, TNF-α 및 β-actin의 primer는 Table 1에 타내었고, 이들의 mRNA 발현을 확인하였다.
Table 1. Primer sequences used in this study
Western blot analysis
RAW264.7 세포를 RE 및 LPS로 처리한 후 HO-1 억제제(SnPP)는 1시간 전에 전처리 하였다. Ice-cold PBS로 2회 세척한 후, RIPA buffer [25 mM Tris·HCl pH 7.6, 150 mM NaCl, 1% NP-40, 1% sodium deoxycholate, 0.1% SDS, protease inhibitors]를 넣어 ice에서 30분간 반응시키고 Whole cell lysate를 제조하여 20분간 원심분리하여 상층액을 모았다. 각 시료의 단백질 정량은 Bradford protein assay (Bio-Rad, Hercules, CA, USA)를 사용하여 595 ㎚에서 흡광도를 측정하여 실시하였다. 동일한 양의 단백질(30 ㎍)을 10% sodium dodecyl sulfate (SDS)-polyacrylamide gel로 분리한 후 iBlot 2 Blotting System (Thermo Fisher, Waltham, MA USA)을 이용하여 transfer하였다. 이 PVDF membrane은 5% non-fat milk block solution에서 1시간 동안 반응시킨 후, 일차 항체를(1:1000 dilution)를 4℃에서 overnight시켰다. TBST 용액으로 3번 세척한 후, 이차 항체는 horseradish peroxidase (HRP)- conjugated anti-rabbit, or anti-mouse IgG (1:10000 dilution)로 실온에서 1시간 반응시켰다. 이어서 3회 세척 후 단백질은 ChemiDoc™ Imaging Systems (Bio-Rad, Hercules, CA, USA)을 이용하여 발현을 확인하였다.
부위별 헛개나무 추출물 HPLC 분석
HPLC 기기는 pump, auto sample, column oven, DAD (Agilent 1260 infinity HPLC system, Agilent Technologies, USA)를 사용하였으며, 분석에 사용된 모든 용매는 J.T. Baker (Phillipsburg, NJ, USA)로부터 구입한 HPLC 급 용매를 사용하였다. 이동상으로 0.1% formic acid를 포함한 물(용매 A)와 아세토나이트릴(용매 B)를 사용하였고, 1 ㎖/min 유속으로 시료 10 ㎕를 주입하여 254 ㎚ 파장에서 gradient condition으로 분석하였으며, 분석 조건은 Table 2와 같다.
Table 2. HPLC conditions for separation of different part extract and major compound from H. dulcis
| Parameter | Condition | ||
| Column | ZORBAX Eclipse plus C18 (4.6 × 150 ㎜, 5 ㎛) | ||
| Flow rate | 1.0 ㎖/min | ||
| Injection volume | 10 ㎕ | ||
| UV detection | 254 ㎚ | ||
| Run time | 50 min | ||
| Gradient | Time (min) | % Az | % By |
| 0 | 95 | 5 | |
| 6 | 95 | 5 | |
| 30 | 30 | 70 | |
| 35 | 30 | 70 | |
| 45 | 0 | 100 | |
| 50 | 0 | 100 | |
y0.1% formic acid in acetonitrile.
헛개나무뿌리 추출물 활성 성분 분리 및 구조 동정
헛개나무 부위별 추출물 중 가장 우수한 항염증 효과를 가진 뿌리 추출물을 Recycling preparative HPLC system을 사용하여 분리하였다. JAIGEL-ODS AP column (20 x 500 ㎜)에 추출물 1 g을 주입하고 혼합 용매 (Water:ACN=1:2, v/v)를 분당 10 ㎖/씩 용출시킨 다음 UV detector를 사용하여 흡광도 254 ㎚에서 측정하였으며, 6개의 소분획(HR1-HR6)으로 나누었다. 이중 HR4를 EtOAc:MeOH(30:1)의 혼합 용매로 preparative TLC를 실시하고 Sephadex LH-20 (95% MeOH)로 정제하여 화합물 1 (30 ㎎)을 얻었다. 최종 정제된 뿌리 추출물의 주요 성분은 Q Exactive plus Orbitrap LC-MS/MS (Thermo Fisher Scientific, MA, USA) 와 900 MHz Bruker AVANCE II NMR (Bruker, MA, USA)을 통하여 얻은 화학 구조상의 수소 및 탄소 골격에 대한 정보를 얻어 정제된 주요 성분의 구조를 동정하였다.
화합물 1 1H-NMR (900 MHz, Acetone-d6) δ 1.68 (1H, m, H-1), 1.01 (1H, m, H-1), 1.59 (2H, m, H-2), 3.16 (1H, m, H-3), 0.8 (1H, m, H-5), 1.54 (1H, m, H-6), 1.35 (1H, m, H-6), 1.63 (1H, m, H-7), 1.48 (1H, m, H-7), 1.42 (1H, m, H-9), 1.55 (1H, m, H-11), 1.19 (1H, m, H-11), 1.79 (1H, m, H-12), 0.91 (1H, m, H-12), 2.54 (1H, m, H-13), 1.96 (1H, m, H-15), 1.49 (1H, m, H-15), 2.23 (1H, m, H-16), 1.35 (1H, m, H-16), 1.83 (1H, m, H-18), 3.09 (1H, m, H-19), 2.07 (1H, m, H-21), 1.40 (1H, m, H-21), 1.94 (1H, m, H-22), 1.49 (1H, m, H-22), 0.91 (3H, s, H-23), 0.90 (3H, s, H-24), 0.77 (3H, s, H-25), 1.05 (3H, s, H-26), 4.72 (1H, d, J = 11.58 Hz, H-27), 4.55 (1H, d, J = 11.84 Hz, H-27), 4.77 (1H, s, H-29), 4.63 (1H, s, H-29), 1.74 (3H, s, H-30), 7.53 (1H, d, J = 2.0 Hz, H-2′), 6.92 (1H, d, J = 8.17 Hz, H-5′), 7.46 (1H, dd, J = 2.15, 8.31 Hz, H-6’); 13C-NMR (225 MHz, Acetone-d6) δ 38.8 (C-1), 27.2 (C-2), 77.7 (C-3), 38.7 (C-4), 55.5 (C-5), 18.2 (C-6), 35.4 (C-7), 41.5 (C-8), 52.0 (C-9), 37.4 (C-10), 21.1 (C-11), 25.4 (C-12), 39.1 (C-13), 45.8 (C-14), 24.2 (C-15), 32.4 (C-16), 55.7 (C-17), 49.4 (C-18), 46.9 (C-19), 149.9 (C-20), 30.4 (C-21), 36.4 (C-22), 27.7 (C-23), 15.4 (C-24), 16.4 (C-25), 16.1 (C-26), 62.8 (C-27), 177.2 (C-28), 109.5 (C-29), 18.9 (C-30), 122.3 (C-1′), 116.2 (C-2′), 144.8 (C-3′), 150.5 (C-4′), 115.0 (C-5′), 122.4 (C-6′), 166.0 (C-7′).
통계처리
모든 실험 결과는 3회 이상 실시하여 그 평균값을 기초로 Mean±SE로 나타내었으며, 실험 결과에 대한 통계처리는 GraphPad Prism 5.0 software (GraphPad Software, Inc., San Diego, CA, USA)를 이용하여 Two-way ANOVA에 준하였고 p-value가 0.05 미만일 경우 유의한 것으로 판정하였다.
결과 및 고찰
NO, PGE2 생성 및 iNOX, COX-2 발현에 미치는 RE의 효과
헛개나무 열매 추출물이 항염증 효과를 나타낸 보고가 있으나 잎, 줄기, 뿌리 추출물의 항염증 효과에 대한 연구는 전무한 실정이다. 헛개나무 부위별 추출물의 항염증 효과를 비교하기 위하여 lipopolysaccharide (LPS)로 염증반응을 유도한 RAW264.7 세포 내 부위별 추출물을 동시에 처리하여 염증의 지표인 nitric oxide (NO) 생성 억제효과를 측정한 결과 Table 3과 같이 헛개나무뿌리 추출물(RE)에서 탁월한 억제효과를 나타내었다. 세포 독성이 나타내지 않는 농도인 10, 20, 그리고 40 ㎍/㎖에서 RE을 이용하여 항염증 효과 및 조절 기전을 관찰하였다. 초기 염증 반응은 inducible nitric oxide synthase (iNOS)와 cyclooxygenase-2 (COX-2)와 이들 단백질에 의한 염증 매개체들(NO, PGE2)이 유도된다. 본 연구에서는 RE의 항염증 효과를 알아보기 위하여 RAW264.7 세포에 RE 10, 20, 그리고 40 ㎍/㎖을 1시간 동안 전 처리한 후 1 ㎍/㎖ LPS를 24시간 동안 처리하여 NO의 생성량에 미치는 영향을 같은 방법으로 분석 결과, 10 ㎍/㎖에서는 53.1%, 40 ㎍/㎖에서는 94.7% 감소시켰다(Fig. 1A). 또한, LPS에 의해 유도되는 PGE2의 생성에 미치는 영향을 분석 결과, 10 ㎍/㎖에서는 47.2%, 40 ㎍/㎖에서는 90.1% 감소시켰다(Fig. 1B).
Table 3. Cell viability and in vitro decrease of nitric oxide production of different part of extract in LPS-stimulated RAW264.7 cells
RE의 항염증 효과에 대한 작용 기전을 알아보기 위하여 체내 염증발현효소(iNOS, COX-2)의 mRNA 발현을 조사하였다. iNOS에 의해서 생성된 NO는 면역반응에서 유용한 역할을 하지만, 지속적인 NO의 생성은 만성 염증 질환을 일으키는 중요한 요인이 된다. 따라서 체내에 과도한 NO를 생성하는 iNOS의 발현에 대한 RE의 영향을 조사하기 위해 RT-PCR을 시행하였다. LPS를 처리한 군에서 iNOS, COX-2 mRNA는 유의적으로 증가하였고, RE를 처리한 군에서는 LPS 처리군과 비교하여 iNOS, COX-2 mRNA의 발현량이 유의적으로 감소함으로 iNOS, COX-2 mRNA 저해효과는 NO, PGE2 생성 억제효과가 유사한 경향을 나타내었다(Fig. 1C and B). 그러므로 RE는 iNOS와 COX-2발현을 억제함으로써 염증 억제 효과를 가짐을 확인할 수 있었다.
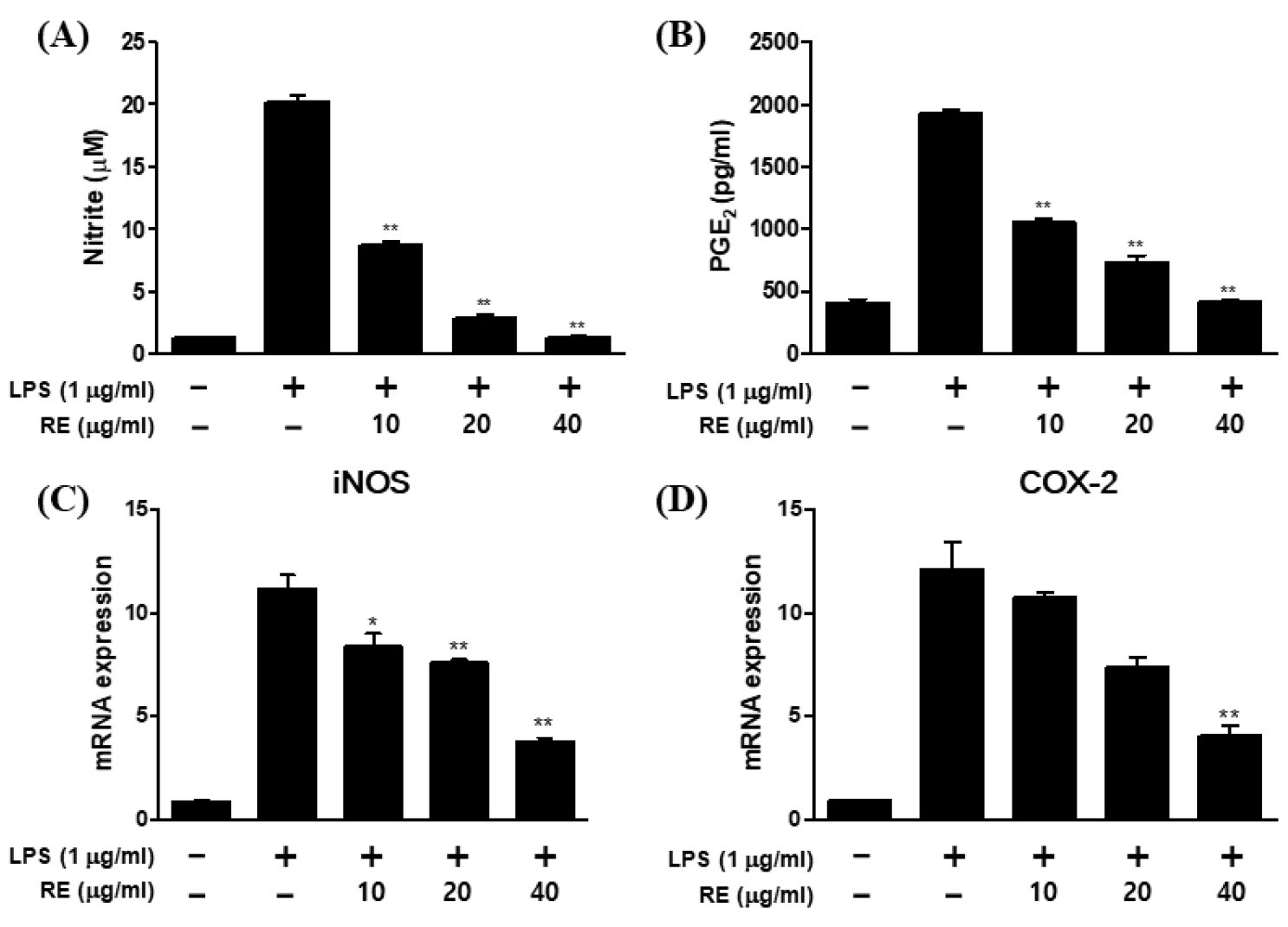
Fig. 1.
Effects of RE on NO and PGE2 production, iNOS mRNA and COX-2 mRNA expression in LPS-stimulated RAW264.7 cells. RAW264.7 cells were stimulated with the indicated concentrations of RE in the presence or absence of LPS (1 ㎍/㎖) for 24 h: (A) amounts of NO were determined using the Griess reaction in culture medium. (B) PGE2 levels in the cell culture medium were detected by ELISA assay. (C and D) The iNOS and COX-2 protein levels were determined 6 h after LPS stimulation. GAPDH was used as an internal control for the real-time PCR assay (n = 4). The data represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
전염증성 cytokines 생성과 mRNA 발현에 미치는 RE의 효과
염증반응이 유도되는 과정에서 NO 및 PGE2와 같은 염증 매개물의 생성과 면역반응을 통한 염증성 cytokine의 생성이 동반되며, 염증을 나타내는 중요한 지표이다(Horwood et al., 2006). 특히 대식세포에서는 LPS 등의 여러 자극 인자에 의하여 활성화가 되면 전염증성 cytokine (TNF-α, IL-6 및 IL-1β)을 증가시키고, 이들은 iNOS의 발현을 유도한다. 실험 결과, LPS를 처리한 군에서는 TNF-α, IL-6, IL-1β 발현이 유의성 있게 증가되었고, RE를 처리한 군에서 TNF-α는 817.2–212.1 pg/㎖, L-6는 885.3–275.6 pg/㎖, IL-1β는 146.6–62.3 pg/㎖로 LPS 처리군과 비교하여 염증인자들을 농도 의존적으로 강력하게 감소하는 확인하였다(Fig. 2A). 위와 같은 결과에 착안하여 mRNA 수준에서도 전염성 인자들을 억제하는지 알아보기로 하였다. TNF-α, IL-6, IL-1β의 mRNA 발현을 정량적 중합 효소 반응 방법으로 측정한 결과 LPS 자극은 mRNA의 발현을 유의성 있게 증가시켰고, RE를 전 처리한 실험 군에서 TNF-α, IL-6 및 IL-1β mRNA 발현이 모두 농도 의존적으로 억제되었다(Fig. 2B). 이 결과들로 통해 RE는 TNF-α, IL-1β 및 IL-6의 생성을 감소시킴으로써 iNOS의 발현을 조절하여 NO 생성을 억제하는 항염증 효과를 나타낸다는 것으로 확인하였다. 모든 실험에 사용된 RE의 농도별 세포독성 여부를 MTT assay를 통하여 알아보았으며 사용된 모든 농도에서 90% 이상의 생존율을 보여 RE은 RAW264.7 세포에서 독성을 나타내지 않는 것을 확인하였다(Fig. 2C).
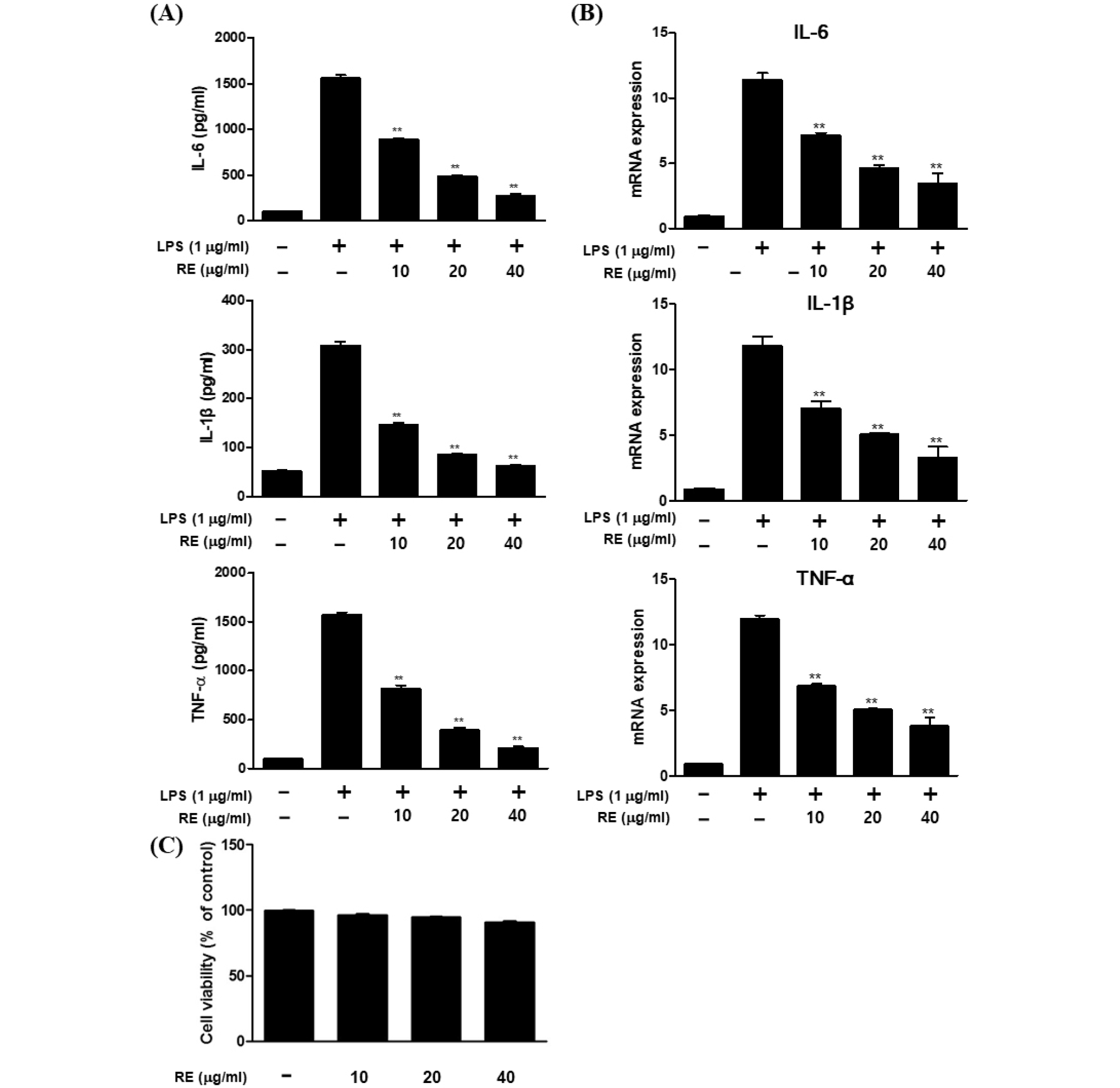
Fig. 2.
Effects of RE on LPS-induced pro-inflammatory cytokine expression in RAW264.7 cells. Cells were treated with the indicated concentration of RE and/or LPS (1 ㎍/㎖) for 24 h (for mRNA): (A) the protein levels of IL-6, IL-1β, and TNF-α in the culture medium were measured using ELISA. (B) The mRNA levels of IL-6, IL-1β, and TNF-α were determined using RT-PCR with specific primers. (C) Cell viability after treatment with RE for 24 h was evaluated by CCK-8 kit assay, and the results are expressed as percentages relative to the untreated control. Date represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
Ik-B 발현량에 미치는 RE의 효과
RAW264.7 세포나 LPS에 의하여 염증이 일어나게 되면 다양한 신호 전달 기전에 의하여 염증성 매개 물질들을 분비하게 되는데, 대표적인 경로인 NF-kB (Nuclear Factor-kappa B)가 있다. NF-kB는 모든 세포에서 발현되는 유도성 전사 인자로 세포 외부 자극에 대한 방어 작용과 면역세포의 활성화를 일으키며 세포의 염증 반응에 관련된 다양한 유전자의 발현을 조절하는 것으로 알려져 있다(Ghosh et al., 2012; Kim et al., 2018). LPS에 의하여 세포막에 존재하는 toll like receptor 4 (TLR4)와 결합하게 되고, 이에 의해 세포질에 있는 전사인자 NF-kB가 활성화되면 결합해 있던 inhibitory kappa Ba (Ik-Ba)가 분해되고, 그에 따라 NF-kB가 세포질에서 핵 내로 이동하여 COX-2, iNOS 등의 전사를 유도한다(Kim et al., 2013). 본 연구에서는 RE 처리에 의해서 감소되는 염증 매개 인자들의 생성 억제가 NF-kB 활성과의 관계를 조사하기 위해 분석한 결과는 Fig. 3과 같다.
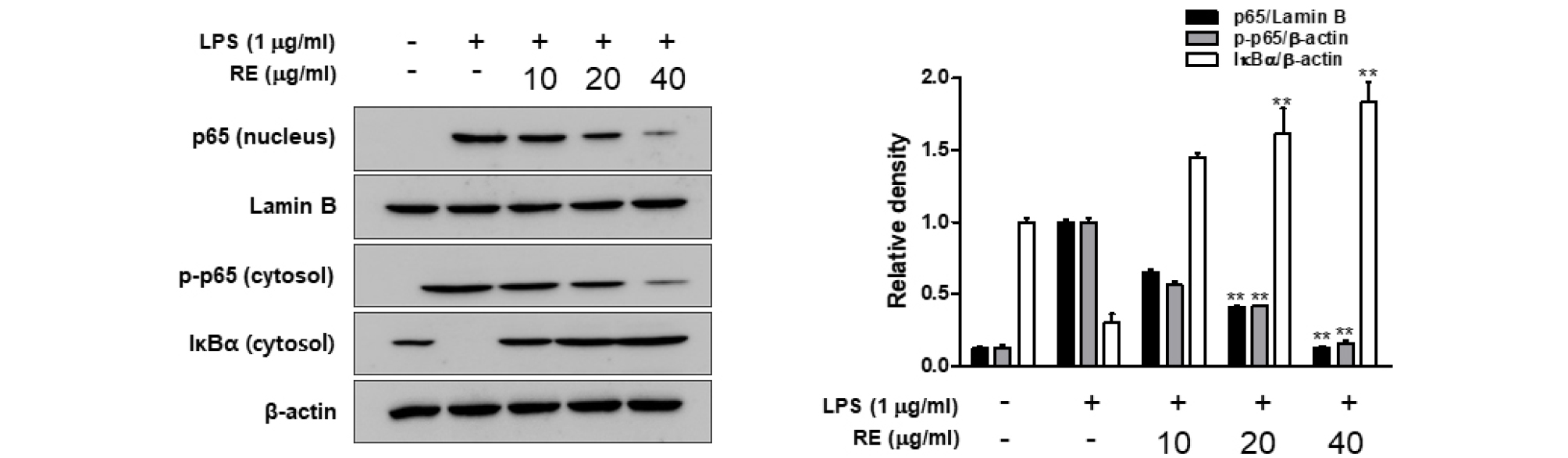
Fig. 3.
Effects of RE on the activation of the NF-kB pathway in LPS-stimulated RAW264.7 cells. Cells were pretreated for 30 min with the indicated concentrations of RE before LPS (1 ㎍/㎖) treatment for 5 min. Nuclear and cytosolic proteins were subjected to Western blot analysis with the indicated antibodies. β-Actin was used as internal controls for the cytosolic and nuclear fractions, respectively. Date represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
LPS를 처리한 군에서 NF-kB의 subunit인 p65의 핵 안으로의 이동이 무처리군과 비교하여 크게 감소하였고, RE를 처리한 군에서는 LPS 처리 군과 비교하여 농도 의존적으로 발현이 감소하였다. 또한 LPS를 처리한 군에서 Ik-Bα의 degradation이 무처리군과 비교하여 뚜렷이 나타났으며, RE에서는 LPS 처리 군과 비교하여 IkB-α의 degradation의 농도 의존적으로 발현을 감소하였다. 결과적으로 RE은 전사 인자인 NF-kB의 활성화를 감소시키고, downstream signaling molecule인 iNOS와 COX-2의 전사를 억제하며, NO의 생성을 감소시켜 항염증 효과를 나타냄을 유추할 수 있었다.
MAPK 활성에 미치는 RE의 효과
MAPK (Mitogen Activated Protein Kinase)의 신호 전달 경로는 염증반응의 활성화에 중요한 역할을 한다. 특히, LPS에 의해 유도된 cytokine의 분비에 p38 MAPK가 중요한 역할을 하고, 폐와 관련된 염증 질환에서는 p38, JNK, ERK 신호 경로가 중요한 역할을 한다고 알려져 있다(Lee and Kang, 2018; Yang et al., 2015). 특히 대식세포에서 LPS는 표면에 TLR4를 자극하여 하부 세포 신호전달 경로인 MAPK의 활성화를 유도하며 활성화된 신호전달 경로는 전염증성 사이토카인, NO, PG와 같은 여러 가지 염증성 매개인자들의 발현을 유도한다(Kim et al., 2010). 본 연구에서는 RE의 항염증 효과가 MAPK 분자 조절에 의한 것인지를 분석 결과는 Fig. 4와 같다. RE 처리에 따른 대식세포 내 인산화된 MAPKs 발현량에 미치는 영향을 Western blot으로 분석한 결과, LPS로 유도된 RAW264.7 세포에는 MAPKs에 속한 단백질이 모두 활성화 되었음을 알 수 있었다. RE의 첨가량이 높아질수록 인산화된 ERK, JNK, p-38의 발현이 LPS 처리 군에 비해 감소하는 것을 확인할 수 있었다. 따라서 RE는 MAPK의 활성화를 억제함으로써 항염증성 cytokine, NO, prostaglandin (PG)s와 같은 여러 염증성 매개인자들의 발현을 억제하는 효과를 나타내었다.
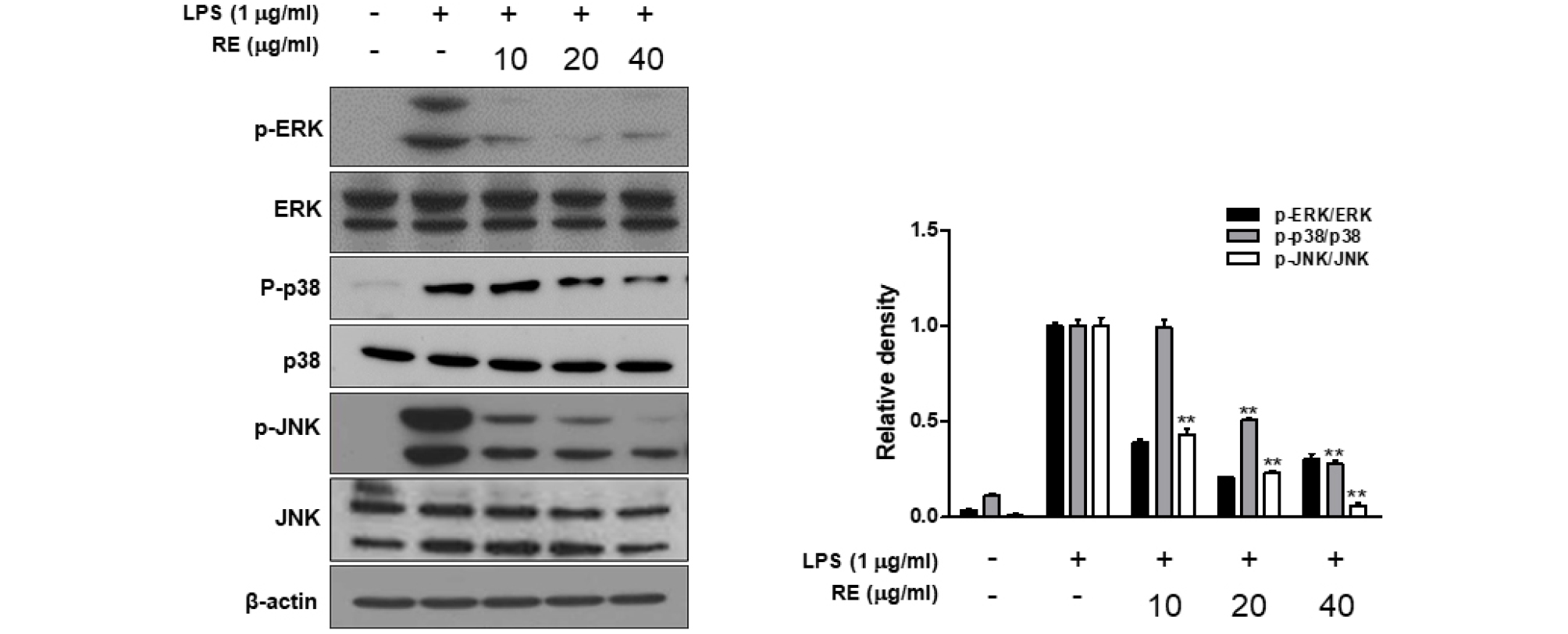
Fig. 4.
Effect of RE on LPS-stimulated MAPKs activation in RAW264.7cells. Phosphorylation and total protein expression of ERK, p38, and JNK were extracts prepared from the cells RE treated with LPS-stimulated analyzed by western blot. Date represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
HO-1 발현 유도에 미치는 RE의 효과/ Nrf2 활성에 미치는 HDRE의 효과
Hemo oxygenase-1 (HO-1)은 heme을 산화시켜 biliverdin, 인산화 탄소(CO), free iron 등을 생성에 관여하는 효소로서 산화적 스트레스에 대한 보호 작용을 하여 염증 반응을 약화시킨다(Kaur et al., 2003). 활성화된 대식세포에 HO-1을 발현시키거나 CO를 처리하면 염증 촉진 사이토카인의 생산이 저해되며, 또한 염증 촉진 매개체의 생산을 억제한다. HO-1단백질 발현의 전사 조절 인자인 nuclear factor-E2-related factor 2 (Nrf2)의 핵 내로의 발현이 매우 중요한 인자로 작용한다. RE가 Nrf2의 전사 여부를 조사하기 위하여 RAW264.7 세포에 RE를 처리한 후 HO-1발현과 Nrf2 활성화를 Western blotting을 이용하여 분석하였다. RE의 농도에 따라 Nfr2는 점점 감소하는 반면, 핵 내부의 Nrf2는 증가하는 양상을 보이는 것을 보아 Nrf2의 핵 내로의 전사가 이루어졌음을 확인할 수 있었다(Fig. 5). LPS를 단독 처리하였을 때보다 RE를 전처리하여 LPS를 처리하였더니 HO-1의 발현이 증가하는 것으로 나타났다. Fig. 5에서 전사조절인자 Nrf2의 세포질과 핵내 발현 양을 확인하였더니 세포질에서는 감소하였으나, 핵 내에서 증가하는 결과를 보였다. 그러므로 RE는 Nrf2 활성을 증가시킴으로 HO-1를 유도한다고 결론지을 수 있다. RE의 항염증 효과와 HO-1의 발현 간의 직접적인 관계를 알아보기 위하여, HO-1 억제제인 Snpp를 이용하여 실험하였다. SnPP를 RE (40 ㎍/㎖)와 함께 12시간 동안 처리한 실험에서 RE에 의해 억제되었던 iNOS와 COX-2가 SnPP를 병용투여함으로써 부분적으로 증가되었다(Fig. 6). 이와 같은 결과로부터 RE에 의한 HO-1 발현이 NO와 PGE2의 생성을 억제하는 것을 확인하였다.
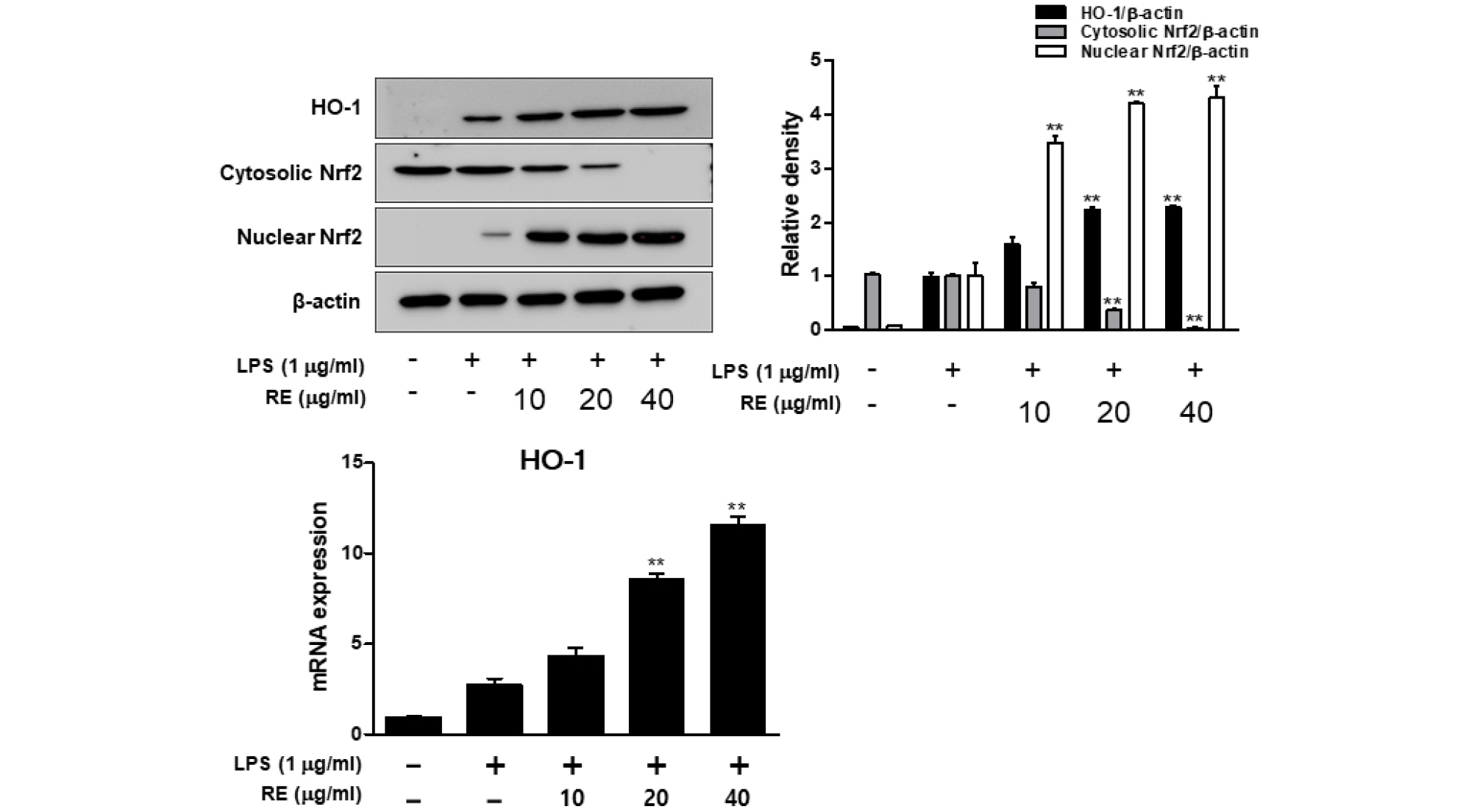
Fig. 5.
Effect of RE on Cytosolic Nrf2, Nuclear Nrf2 and HO-1 expression in LPS-stimulated RAW264.7cells. Cells were pretreated for 1 h with various concentrations of RE (10-40 ㎍/㎖) and stimulated with LPS (1 ㎍/㎖) for 24 h. The Cytosolic Nrf2, Nuclear Nrf2 and HO-1 protein expression were analyzed by western blot analysis. The mRNA level was analyzed by real-time PCR. Date represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
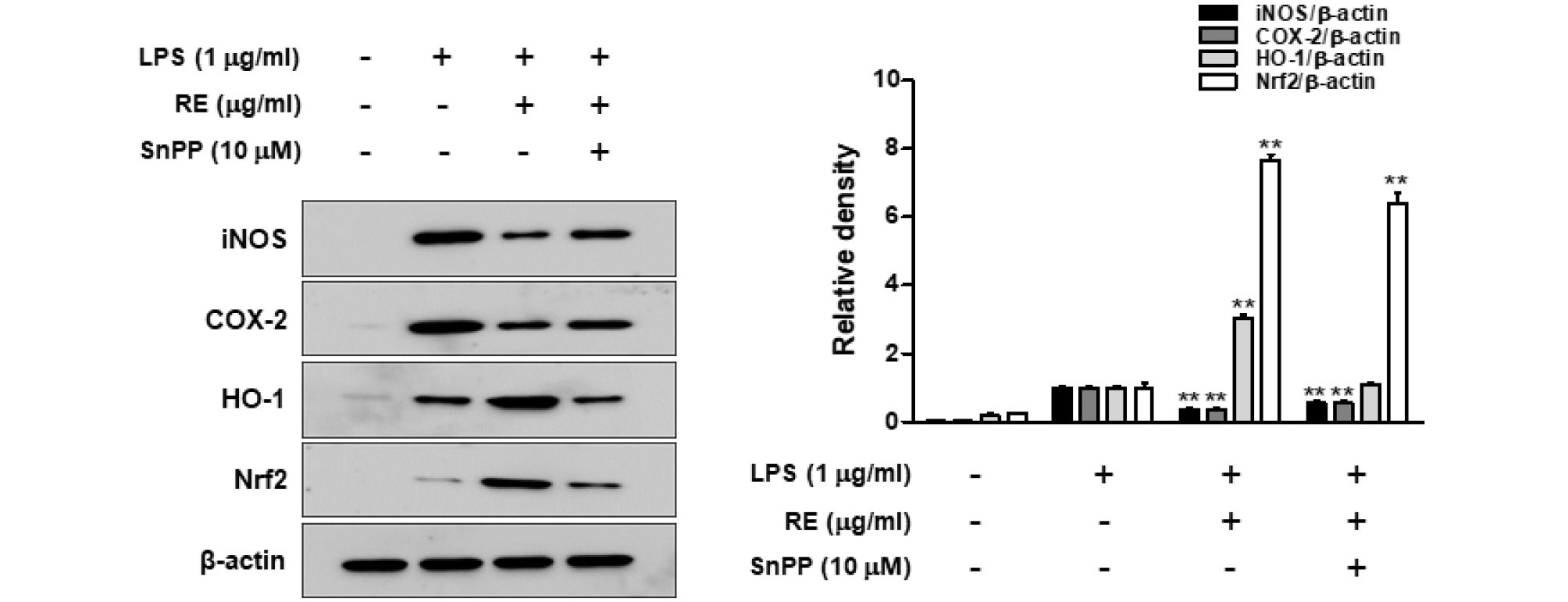
Fig. 6.
Effect of RE on iNOS, COX-2, HO-1 and Nrf2 expression in LPS-stimulated RAW264.7 cells. Cell were pretreated with 10 µM SnPP for 1h prior to with various concentrations of RE (10-40 ㎍/㎖) and stimulated with LPS (1 ㎍/㎖) for 24 h. The iNOS, COX-2, HO-1 and Nrf2 protein expression were analyzed by western blot analysis. Date represent the mean ± S.D of three experiments. *p<0.05, **p<0.001 compared to LPS alone.
헛개나무 부위별 성분분석 및 주요 성분의 구조 동정
부위별 헛개나무 추출물의 주요 성분 차이를 비교하기 위하여 HPLC를 이용하여 분석하였다. 그 결과 잎, 줄기 추출물에 비해 뿌리 추출물에서 일정한 주요 피크(29.5 min)를 확인할 수 있었다(Fig. 7). 본 연구에서는 뿌리 추출물에서 추출되는 주요 성분을 Recycling preparative HPLC system를 이용하여 분리 및 정제하였다. 화합물 1 (White powder)는 obitrap/MS 분석을 수행하였으며, m/z 607.3649 [M]+의 분자 이온 peak가 관측되어 분자량을 608.8046로 결정하였다. 1H NMR spectrum (in Acetone-d6, 900 MHz)에서 δ 1.05, 0.91, 0.90 및 0.77에서 4개의 angular methyl group과 δ 3.16에서 multiplet으로 나타나는 triterpene의 통상적인 3번 oxymethine proton을 확인할 수 있었다. δ 1.74에서 sp2 carbon에 결합하고 있는 또 하나의 methyl group을 확인하였고, δ 4.77 및 4.63에서 각각 singlet으로 나타나는 두 개의 olefin proton을 확인하여 이 화합물이 isopropenyl group을 가지고, δ 4.72, 4.55에서 doublet으로 나타나는 하나의 oxygenate methylene group과 aromatic 영역의 δ 7.53, 6.92, 7.46에서 ABX system의 proton coupling으로 protocatechuoyl group을 함유하고 있는 lupane 계열의 triterpenoid 임을 추정할 수 있었다. 13C-NMR spectrum (in Acetone-d6, 225 MHz)에서는 총 37개의 signal을 확인하여 triterpene 임을 확인하였다. δ 27.7, 15.3, 16.3, 16.1 및 18.8에서 5개의 methyl 기를 확인하였고, δ 77.7에서 3번의 oxymethine carbon을, δ 149.9 및 109.4에서 isopropenyl group의 olefin carbons을 확인하였고, δ 62.8에서 oxygenated methylene carbon의 전형적인 signal임을 다시 한번 확인할 수 있고, δ 165.9는 protocatechuoyl group의 carboxy carbon을 확인할 수 있었다. 따라서 NMR 분광분석 및 MS 분석에 의하여 헛개나무뿌리 주요 성분의 화학구조가 lupane 계의 triterpenoid인 27-O-protocatechuoylbetulinic acid 임을 규명할 수 있었다(Kang et al., 2017).
적요
본 연구는 헛개나무 잎, 줄기, 뿌리로부터 얻어진 메탄올 추출물의 항염증 효과를 구명하기 위해서 수행되었다. LPS로 염증이 유도된 RAW264.7 세포 내 부위별 추출물을 동시에 처리하여 염증 매개성 물질인 NO 생성량 분석 결과 40 ㎍/㎖ 농도에서 뿌리(94.7%)와 줄기(42.6%)에서는 효과가 있는 반면 잎에서는 효과가 없는 것으로 확인되었다. 이 중 탁월한 효과를 보인 뿌리 추출물(RE)의 항염증 효과 및 관련 분자적 기전을 확인하였다. 그 결과, 염증 반응의 주요 경로인 NF-kB 및 MAPK 신호전달 경로에서 RE가 LPS로 유도된 NF-kB의 핵 이동을 억제하고, ERK, JNK, p38의 인산화를 억제함으로써 iNOS, COX-2의 발현이 감소되고, NO와 pro-inflammatory cytokine (IL-6, IL-1β, TNF-α)의 생성이 억제됨을 확인하였다. 또한 RE는 대식세포에서 Nrf2를 활성화시켜 항염증성 단백질인 HO-1 발현을 유도하여 항염증 효과를 나타내었다. 또한, RE로부터 주요 성분을 분리한 후 NMR과 MS 기기를 이용하여 구조 동정된 27-O-protocatechuoylbetulinic acid 화합물에서도 높은 항염증 효과를 확인하였다. 이러한 연구결과는 헛개나무뿌리와 그 주요성분은 의약품 소재 및 기능성 식품 등의 기능성 소재로 활용될 수 있는 기초적인 정보를 제공할 것으로 생각된다.