서언
재료 및 방법
실험재료
추출물 제조
세포 생육 억제활성 측정
Cell migration assay
Wound healing assay
Reverse transcriptase-polymerase chain reaction (RT-PCR)
SDS-PAGE 및 Western blot 분석
통계분석
결과 및 고찰
댕댕이나무의 대장암세포 HCT116과 SW480의 세포생육에 미치는 영향
댕댕이나무 잎과 가지 추출물의 대장암 세포 HCT116과 SW480의 cell migration에 미치는 영향
댕댕이나무 잎과 가지 추출물의 대장암 세포 HCT116과 SW480에서 Wnt 신호전달에 미치는 영향
적요
서언
한국의 주요 사망원인으로 알려져 있는 암은 1983년 이래 한국의 주요 공중 보건 문제로 여겨져 왔다(Jung et al., 2019). 한국에서 매년 220,000명 이상의 암환자가 발생하고 있다(Jung et al., 2019). 기존의 암치료법의 발전에도 불구하여 암은 여전히 한국의 주요 사망원인이다(Bae et al., 2018). 암 종류 중에, 대장암은 전 세계적으로 세 번째로 가장 많이 진단되는 암이며, 한국에서는 주요 악성 종양 중 하나로 인식되고 있다(Park et al., 2016). 대장암의 발병은 최근 수십 년 동안 서구화와 경제 발전으로 인한 생활양식의 변화와 같은 환경적 요인으로 지속적으로 증가하고 있는 실정이고(Center et al., 2009), 서구화된 식이 패턴이 대장암의 발병 위험을 증가시키는 주요한 원인으로 알려져 있다(Park et al., 2016).
최근 수천 년 동안 암을 치료하는 사용된 전통의약품에 대한 과학적 연구가 강조되고 있고, 실제로 많은 약용식물이 암을 예방하고 치료하는 것으로 보고되어 왔다 (Aggarwal et al., 2006; Hsiao and Liu, 2010). 그 결과, 지난 25년 동안, 항암제로 승인된 81개의 의약품 중 63개(77.8%)가 천연물을 기반으로 개발되어 왔고(Newman and Cragg, 2007), 여전히 약용식물은 새로운 항암제 개발을 위한 중요한 천연물소재로 활용되고 있다.
댕댕이나무(Lonicera caerulea)는 인동과(Caprifoliaceae) 인동덩굴속에 속하는 낙엽관목으로 북유럽, 북아메리카, 북동아시아 등에 분포하고 있다고 알려져 있다(Plekhanova, 2000; Smolik et al., 2010). 댕댕이나무는 중국, 일본, 러시아에서 약용식물로 사용되어져 왔다(Lee et al., 2018). 허니베리(Honeyberry)라고 불리는 댕댕이나무 열매는 ascorbic acid와 안토시아닌, 플라보노이드 및 저분자 페놀산과 같은 폴리페놀 성분이 포함되어 있어 강력한 항산화 활성이 있다고 보고 되었고(Svarcova et al., 2017), 12종의 베리 중에서 항산화 활성이 가장 높은 것으로 알려져 있다(Chen et al., 2014). 또한, 댕댕이나무 열매는 항염증 활성(Jin et al., 2006; Zdarilova et al., 2010), 간보호 활성(Palikova et al., 2009), 지질 및 포도당 대사 촉진 활성(Jurgonski et al., 2013), 갑상선 기능 항진증에 대한 치료 활성(Park et al., 2016), 항비만 활성(Kim et al., 2018), 항암활성(Pace et al., 2018; Zhou et al., 2018) 등이 있는 것으로 보고되고 있다. 기존의 항암활성 연구에서 댕댕이나무 열매는 간암세포인 HepG2세포와 유방암 세포인 MDA-MB-231세포의 세포생육을 억제하고 세포사멸을 유도한다고 보고되었다(Pace et al., 2018; Zhou et al., 2018). 그러나 댕댕이나무의 항암활성을 포함하는 다양한 기능성 연구는 주로 열매에 관한 것이며, 잎과 가지의 기능성 연구는 전무한 실정이다. 잎과 가지는 열매보다 기능성 물질과 생물학적 활성이 높기 때문에 인간 질환 예방 및 치료를 위한 천연식의약품 개발에 중요한 소재로 여겨지고 있다(Szopa et all., 2017). 실제로, 초크베리(Chokeberry) 잎과 열매의 기능성 물질과 항산화 활성에 대한 비교 연구에서, 잎은 열매보다 기능성 물질의 함량이 높고 항산화 활성이 높은 것으로 보고되었다(Szopa et al., 2017). 따라서, 본 연구에서는 댕댕이나무의 부위별(잎, 가지, 열매) 추출물을 이용한 대장암세포에 대한 생육억제활성 확인을 통해 대장암에 대한 치료 혹은 예방적 소재로서의 개발 가치를 평가하고자 하였다.
재료 및 방법
실험재료
대장암세포의 배양을 위한 배지인 DMEM/F-12는 Lonza (Morristown, NJ, USA) 에서 구매하였다. 세포생육 측정을 위한 3-(4,5-dimethylthizaol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT)는 Sigma-Aldrich (St. Louis, MO, USA)사에서 구입하였다. 그리고 Western blot을 활용한 단백질 분석을 위한 항체인 β-catenin과 TCF4 및 actin은 Cell Signaling Technology (Danvers, MA, USA)에서 구입하였다.
추출물 제조
본 실험에 사용된 시료인 Lonicera caerulea)는 국립산림과학원 산림약용자원연구소로부터 제공받았다. 댕댕이나무의 확증표본(표본번호: FMCLC-20190506-01)은 국립산림과학원 산림약용자원연구소의 식물학적 동정 후, 국립산림과학원 산림약용자원연구소에 보관하고 있다. 동결건조 후 분쇄된 댕댕이나무 잎, 가지 그리고 열매 20 g을 70% 에탄올 400 mL에 침지한 후 상온에서 250 rpm으로 교반하면서 3일 동안 추출하였고, 15,000 rmp에서 10분간 원심분리하여 70% 에탄올 추출물을 회수하였다. 회수된 댕댕이나무 잎, 가지 그리고 열매 70% 에탄올 추출물은 40℃ 이하의 중탕에서 감압 환류 냉각장치(N-1110S, EYELA, Tokyo, Japan)로 감압농축 후 동결건조하여 최종 에탄올 추출물을 얻었다. 동결건조 된 추출물은 -80℃의 냉동고에 보관하면서 분석을 위한 시료로 사용되었다. 댕댕이나무 잎(LCLE), 가지(LCBE) 또는 열매(LCFE0 추출물은 각각 dimethyl sulfoxide (DMSO)에 용해하여 실험에 사용하였고, 대조군은 DMSO를 0.1%를 초과하지 않는 범위에서 사용하였다.
세포 생육 억제활성 측정
본 연구에서 사용된 대장암세포 HCT116과 SW480은 American Type Culture Collection (Manassas, VA, USA)에서 구입하였고, 세포는 10% FBS, 100 U/mL penicillin과 100 ㎍/mL streptomycin이 포함된 DMEM/F-12 배지로 37℃, 5% CO2 하에서 배양되었다. 댕댕이나무 잎, 가지, 그리고 열매 추출물의 대장암세포 생육억제는 MTT assay로 측정하였다. 각각의 암세포를 96-well plate에 well 당 1 × 104 cells로 24 시간 배양한 후, 댕댕이나무 잎, 가지, 그리고 열매 추출물을 농도별 처리하고 24, 48 또는 72시간 동안 배양시켰다. 처리 후 각각의 well에 MTT 용액(1 ㎎/mL)을 50 μL씩 첨가하고 4시간 반응시킨 후, 상등액을 제거하고 DMSO를 100 μL씩 각각의 well에 첨가하여 녹인 후 UV/Visible spectrophotometer (Xma-3000PC, Human Corporation Co., Seoul, Korea)를 이용하여 570 ㎚에서 흡광도를 측정하였다.
Cell migration assay
댕댕이나무 잎과 가지 추출물의 대장암세포 HCT116의 cell migration 억제활성은 CytoSelectTM 24-Well Cell Migration and Invastion Assay Kit (CELL BIOLABS, INC. San Diego, CA, USA)를 활용하여 제조사의 방법에 따라 수행되었다. 간단하게, FBS가 함유된 DMEM배지 500 μL를 24-well migration plate에 분주한 후, FBS가 함유되지 않은DMEM 배지에 댕댕이나무 잎과 가지추출물과 HCT116 세포를 희석하여 24-well migration plate 상층챔버에 넣고 24시간 배양시켰다. 24시간 후, cell stain solution으로 세포를 염색하여 현미경으로 세포를 관찰하였다.
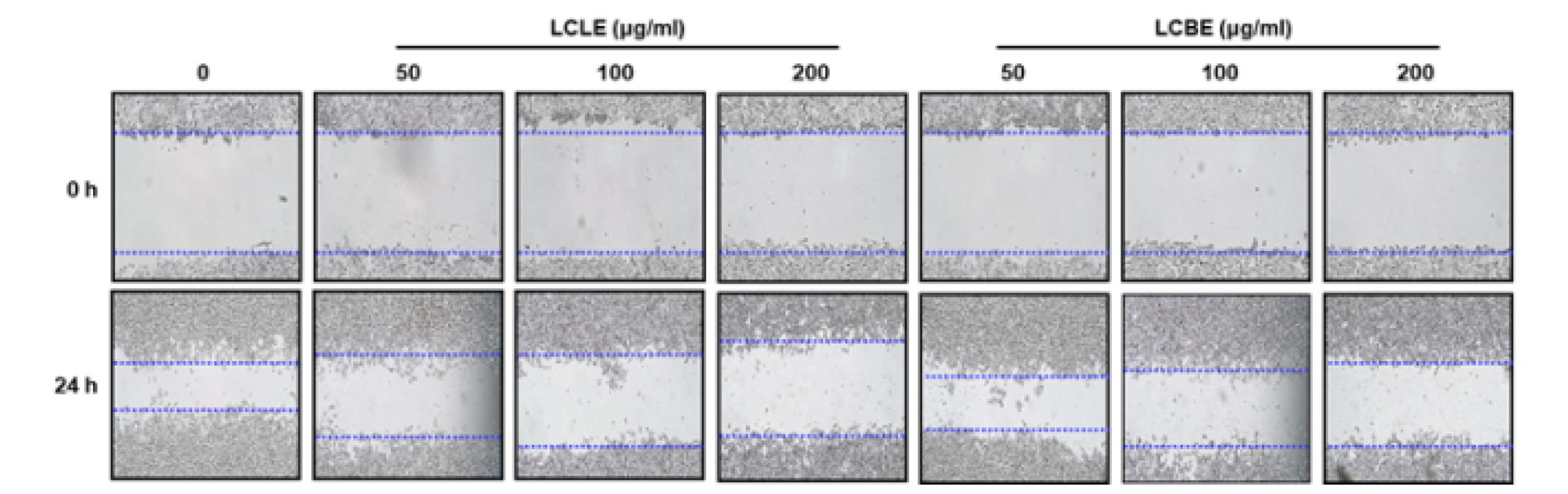
Wound healing assay
댕댕이나무 잎과 가지 추출물의 대장암세포 HCT116의 wound healing 억제활성은 CytoSelectTM 24-Well Wound Healing Assay Kit (CELL BIOLABS, INC. San Diego, CA, USA)를 활용하여 제조사의 방법에 따라 수행되었다. 간단하게, 12-well plate에 배양된 HCT116 세포를 1 × PBS로 3회 세척 후, FBS가 함유되지 않는 DMEM 배지로 6시간 starvation시켰다. 6시간 후 200 μL pipette tip을 사용하여 wound를 생성한 후, FBS가 함유되지 않는 DMEM배지로 세포 잔해를 제거하였다. 그 후 댕댕이나무 잎과 가지 추출물을 처리하여 24시간 동안 배양하였다. 24시간 후 현미경으로 세포를 관찰하였다.
Reverse transcriptase-polymerase chain reaction (RT-PCR)
세포에서 RNA를 추출하기 위해서 세포를 4℃에서 유지된 1 × PBS로 2회 세척한 후, RNeasy Mini kit (QIAGEN GmbH., Hilden, Germany)를 이용하여 total RNA를 추출하였다. 1 ㎍의 total RNA를 Verso cDNA synthesis kit (Thermo Fisher Scientific Inc., Waltham, MA, USA)를 이용하여 cDNA를 합성하였다. PCR은 PCR Master Mix Kit (Promega Co., Madison, WI, USA)를 이용하여 수행되었고, 사용된 primer는 Table 1과 같다.
Table 1.
Sequence of oligonucleotide primers used for RT-PCR
SDS-PAGE 및 Western blot 분석
세포로부터 단백질을 추출하기 위해, 처리 후 세포를 4℃에서 유지된 1 × phosphate-buffered saline (PBS)로 2회 세척한 후, protease inhibitor cocktail (Sigma-Aldrich Co.)과 phosphatase inhibitor cocktail (Sigma-Aldrich Co.)이 포함된 NP-40 lysis buffer (GenDEPOT, Katy, TX, USA)를 4℃에서 1시간 처리하여 단백질을 추출하였다. 추출된 단백질은 Bicinchoninic acid protein assay (Pierce Biotechnology Inc., Waltham, MA, USA)로 정량분석 후, 동일량의 단백질을 8% SDS-acrylamide gel로 전기영동하고 PVDF membrane (Bio- Rad, Hercules, CA, USA)에 이동시킨 후 5% non-fat dry milk로 상온에서 1 시간 동안 blocking 하였다. 1시간 후, 1차 항체를 5% non-fat dry milk에 용해시켜 4℃에서 16시간 동안 반응시킨 후 membrane을 0.05% tween-20이 포함된 tris-buffered saline (TBS-T)로 5분간 3회 세척하였다. 그 후 2차 항체는 5% non-fat dry milk에 용해시켜 membrane에 상온에서 1시간 처리하였고, TBS-T로 5분간 3회 세척 후 membrane은 ECL western blotting substrate (Amersham Biosciences Co., Little Chalfont, England)를 이용하여 단백질을 확인하였다.
통계분석
모든 결과는 3 회 반복 측정 후 평균 ± 표준편차로 나타내었고, 처리간 유의성은 Student’s t-test로 검증하여 p-value 값이 0.05 미만일 때 통계적으로 유의하다고 판정하였다(Microsoft Exel 2010, Microsoft, Redmond, WA, USA).
결과 및 고찰
댕댕이나무의 대장암세포 HCT116과 SW480의 세포생육에 미치는 영향
암은 통제되지 않는 세포성장을 특징을 가지고 있기 때문에 신체의 다른 부분으로 침입하여 퍼질 가능성이 있다(Kikuchi et al., 2019). 그리하여 댕댕이나무 부위인 잎(LCLE), 가지(LCBE), 그리고 열매 추출물(LCFE)의 대장암세포에 대한 항암활성을 평가하기 위하여 MTT assay를 이용하여 대장암세포인 HCT116과 SW480의 세포생육에 미치는 영향을 평가하였다. 그 결과, 댕댕이나무 잎과 가지 추출물은 시간 및 농도 의존적으로 HCT116과 SW480 세포의 세포생육을 억제하였으나 댕댕이나무 열매 추출물은 HCT116과 SW480 세포의 세포생육에 아무런 영향이 없었다(Fig. 1). 본 결과를 미루어 볼 때, 댕댕이나무 잎과 가지 추출물은 대장암세포에 대한 항암활성이 있는 것으로 판단된다.
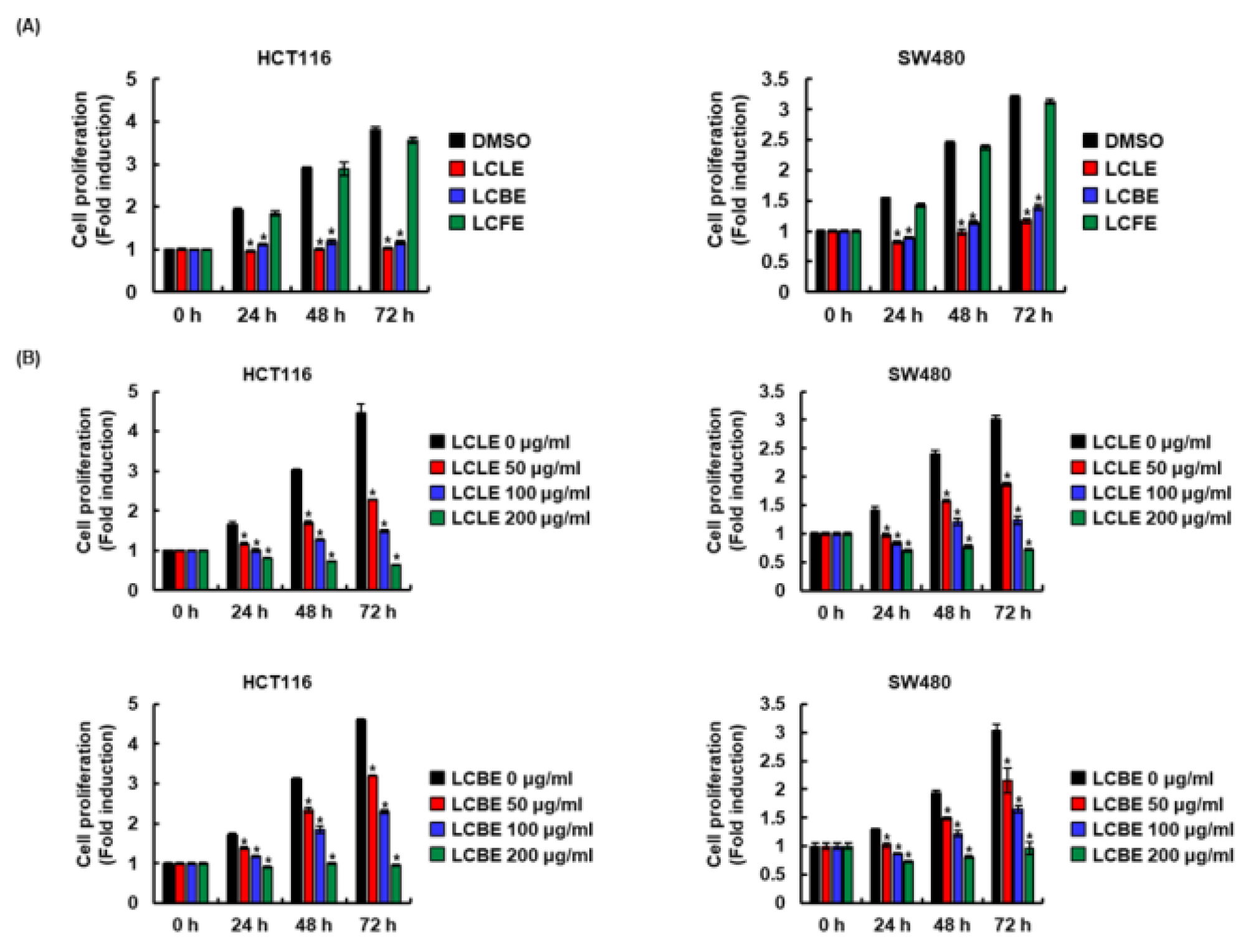
Fig. 1.
Effect of LCLE, LCBE and LCFE on the cell viability in HCT116 and SW480 cells. (A) HCT116 and SW480 cells were treated with 100 ㎍/mL of LCLE, LCBE or LCFE for the indicated times. (B) HCT116 and SW480 cells were treated with the indicated concentrations of LCLE and LCBE for the indicated times. Cell grwoth was evaluated by MTT assay after treatment. *p < 0.05 compared to cell without LCLE, LCBE or LCFE.
댕댕이나무 잎과 가지 추출물의 대장암 세포 HCT116과 SW480의 cell migration에 미치는 영향
암 발생과 진행단계에서, 암세포의 침윤과 전이는 순환계 및 림프계를 통해 암세포가 확산될 때 일어난다(Friedl and Wolf, 2003; Friedl and Alexander, 2011). 비정상적인 세포증식에 따른 암세포의 migration은 암세포의 전이에 필수적이라고 보고되고 있다(Chambers et al., 2002; Friedl and Wolf, 2003). 따라서 암세포의 migration을 억제하는 항암제의 개발은 암세포의 전이를 효과적으로 억제할 수 있기 때문에 중요하다고 보고되고 있다(Jones et al., 2006). 그리하여 댕댕이나무 잎(LCLE)와 가지(LCBE) 추출물이 대장암세포 HCT116의 migration을 억제하는지 cell migration assay로 확인하였다. 그 결과, 댕댕이나무 잎과 가지추출물은 효과적으로 HCT116 세포의 migration을 억제하는 것으로 나타났다(Fig. 2). 또한 wound healing assay는 암세포의 migration을 평가하기 위해 공통적으로 사용되고 있는 연구방법이기 때문에, Wound healing assay를 활용하여 댕댕이나무 잎과 가지 추출물의 HCT116 세포의 migration 억제를 재검증하였다. 그 결과, 댕댕이나무 잎과 가지추출물은 HCT116 세포의 wound healing을 효과적으로 억제하는 것으로 나타났다(Fig. 3). 본 결과를 미루어 볼 때, 댕댕이나무 잎과 가지 추출물은 대장암세포의 migration 억제는 향후 암세포의 전이를 억제하는 항암제 개발에 중요한 소재로 활용될 수 있을 것으로 판단된다.
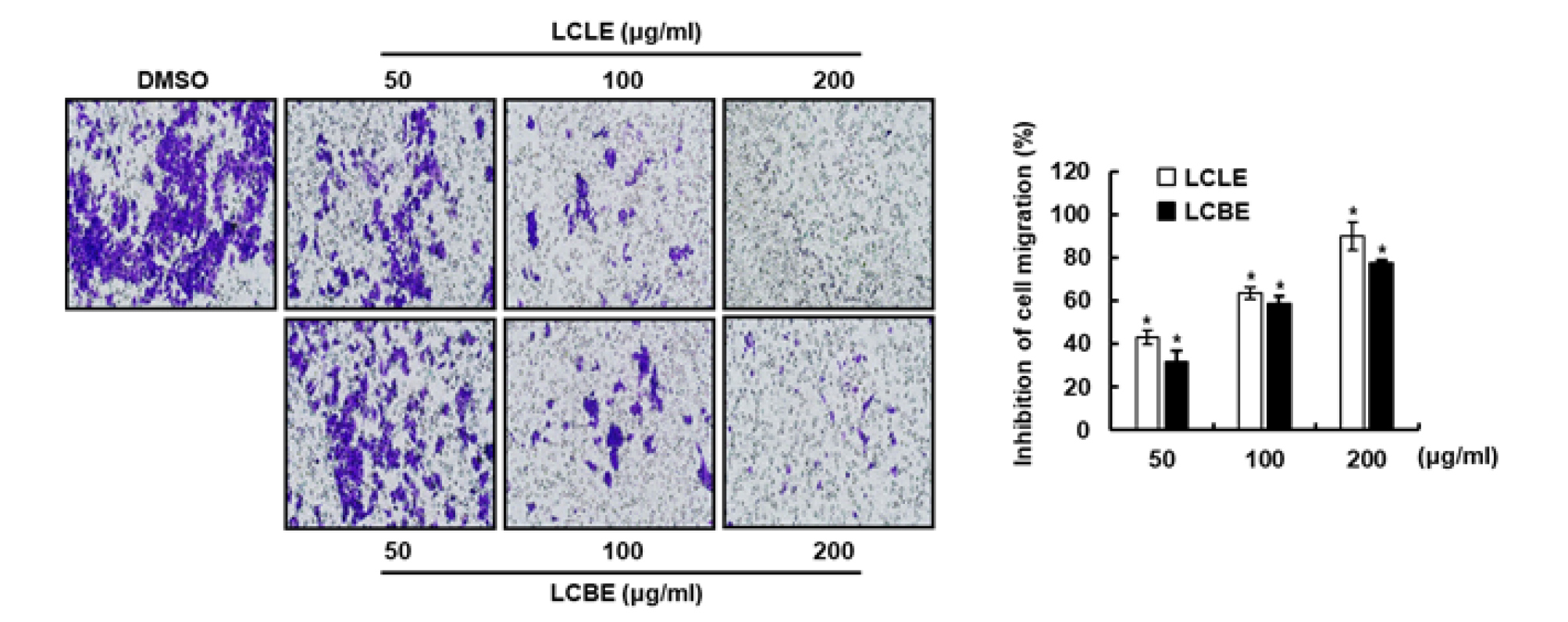
Fig. 2.
Effect of LCLE and LCBE on the cell migration in HCT116 cells. Cell migration assay was performed using CytoSelectTM 24-Well Cell Migration and Invastion Assay Kit according to the manufacturer’s protocol. HCT116 cells were treated with LCLE and LCBE at the indicated concentrations for 24 h. *p < 0.05 compared to cell without LCLE, LCBE or LCFE.
댕댕이나무 잎과 가지 추출물의 대장암 세포 HCT116과 SW480에서 Wnt 신호전달에 미치는 영향
암발생과 진행단계에서 비정상적인 Wnt 신호전달의 활성화는 Wnt 신호전달 구성단백질인 β-catenin의 세포질 축적 유도하고, 세포질에 축적 된 β-catenin은 핵으로 이동하여 전사인자와 복합체를 형성함으로써 암세포의 세포증식과 관련된 표적 유전자의 발현을 증가시킨다(He et al., 1998; Neth et al., 2006; Neth et al., 2007; Tetsu and McCormick, 1999). 비정상적인 β-catenin 신호전달은 전립선 암, 흑생종, 골수종, 간암, 대장암, 유방암 및 폐암으로 포함한 많은 악성 종양의 공통적인 특징으로 알려져 왔다(Kim et al., 2019; Yang et al., 2017). 게다가 비정상적인 β-catenin 신호전달의 활성화는 많은 암세포의 migration을 통한 침윤과 전이를 촉진한다고 보고되고 있다(Iwai et al., 2010). 그리하여 댕댕이나무 잎(LCLE)과 가지(LCBE) 추출물이 대장암 세포인 HCT116과 SW480의 β-catenin 단백질 발현에 미치는 영향을 평가하였다. 그 결과, 댕댕이나무 잎과 가지는 농도의존적으로 HCT116과 SW480 세포의 β-catenin 단백질 수준을 감소시켰으나(Fig. 4A and B), β-catenin mRNA의 발현에는 영향이 없는 것으로 나타났다(Fig. 4C). 본 결과를 미루어 볼 때, 댕댕이나무 잎과 가지는 대장암세포에서 proteasoma degradation을 유도하여 β-catenin 단백질의 수준을 감소시키는 것으로 사료된다. TCF4는 β-catenin과 함께 Wnt 신호전달 경로의 주요한 전사 매체로 알려져 있다(Hrckulak et al., 2018). 특히, TCF4는 대장암에서 과대발현되어 있는 것으로 보고되고 있다(Ghadimi et al., 2016). 그리하여, 댕댕이나무 잎과 가지 추출물이 HCT116과 SW480의 TCF4 단백질 발현에 미치는 영향을 평가하였다. 그 결과(Fig. 5), 댕댕이나무 잎 추출물은 HCT116과 SW480세포에서 TCF4의 mRNA와 단백질 수준을 모두 감소시키는 것으로 나타났다. 본 결과를 미루어 볼 때, 댕댕이나무 잎은 대장암세포에서 TCF4의 전사를 억제하여 TCF4 단백질의 수준을 감소시키는 것으로 사료된다. 그러나, 댕댕이나무 가지 추출물은 HCT116과 SW480 세포의 TCF4 단백질 수준을 감소시켰으나 TCF4 mRNA의 발현에는 영향이 없는 것으로 나타났다. 본 결과를 미루어 볼 때, 댕댕이나무 가지는 대장암세포에서 proteasoma degradation을 유도하여 TCF4 단백질의 수준을 감소시키는 것으로 사료된다. 댕댕이나무 잎과 가지 추출물이 β-catenin과 TCF4 단백질 수준을 감소 시키는 것으로 볼 때, 댕댕이나무 잎과 가지는 대장암세포에서 비정상적인 Wnt 신호전달을 억제하는 것으로 판단된다.
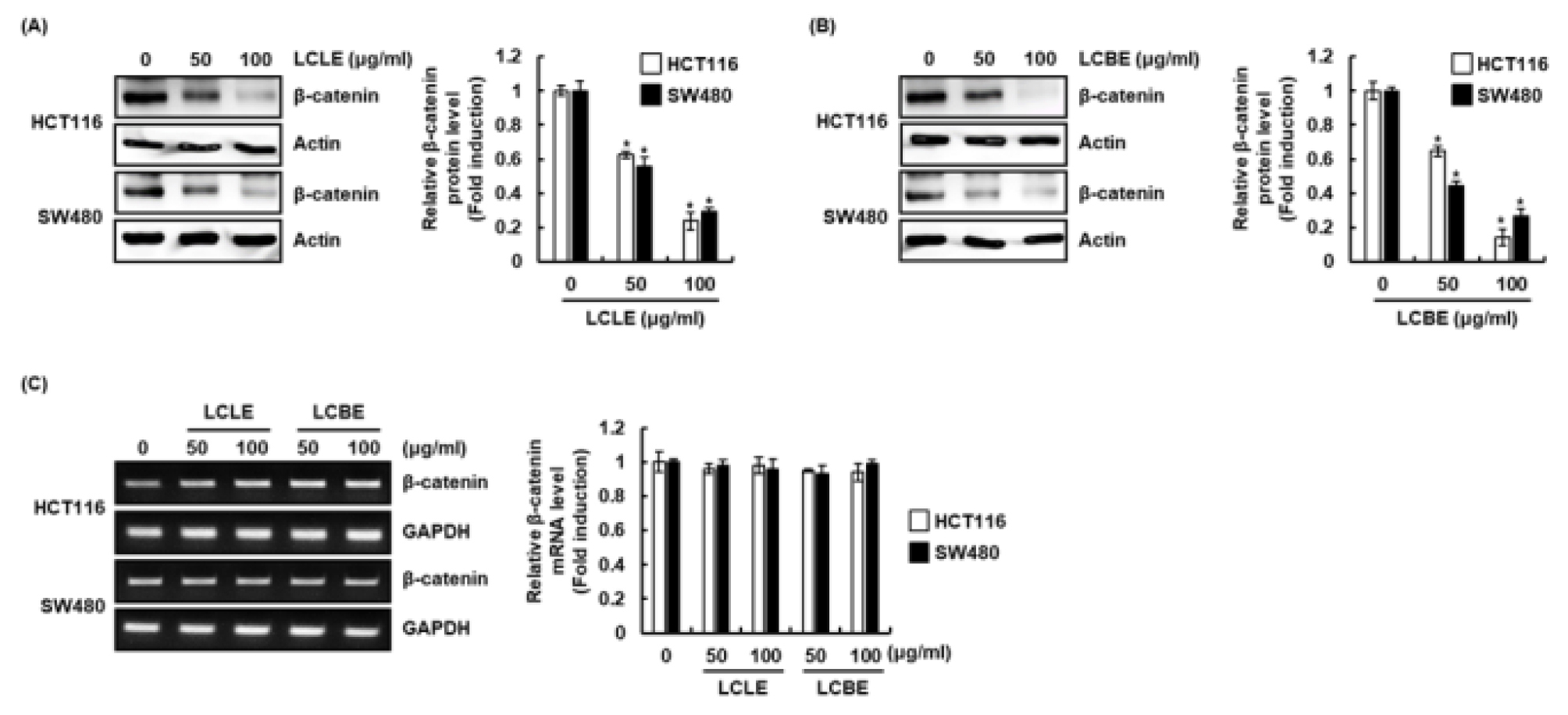
Fig. 4.
Effect of LCLE and LCBE on β-catenin level in HCT116 and SW480 cells. HCT116 and SW480 cellswere treated with LCLE and LCBE at the indicated concentrations for 24 h. β-catenin protein level was analyzed using Western blot (A and B) and β-catenin mRNA level was analyzed using RT-PCR (C). The density of protein and mRNA bands was calculated using the software UN-SCAN-IT gel version 5.1 (Silk Scientific Inc. Orem, UT, USA). *p < 0.05 compared to the cells without the treatment.
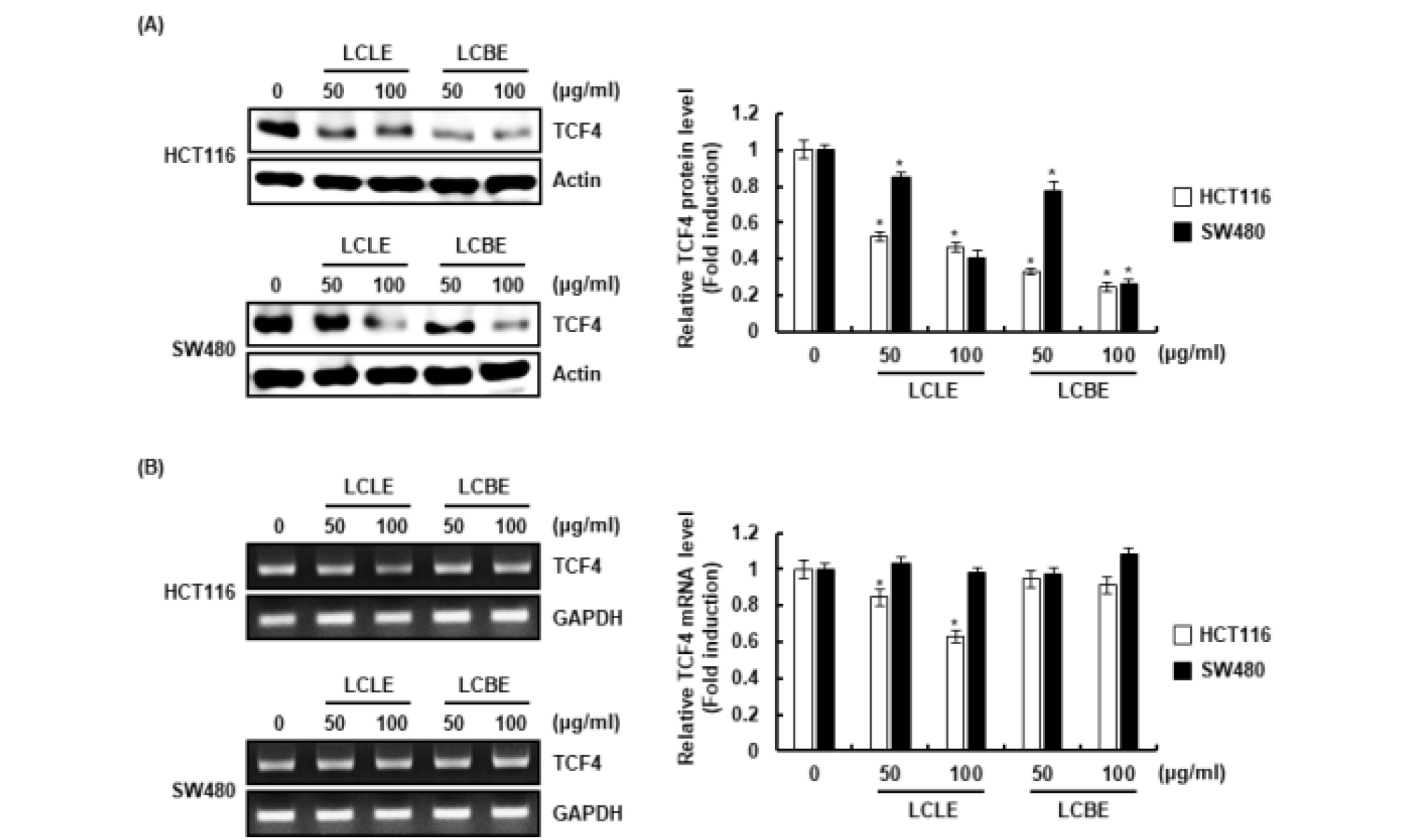
Fig. 5.
Effect of LCLE and LCBE on TCF4 level in HCT116 and SW480 cells. HCT116 and SW480 cellswere treated with LCLE and LCBE at the indicated concentrations for 24 h. TCF4 protein level was analyzed using Western blot (A) and TCF4 mRNA level was analyzed using RT-PCR (B). The density of protein and mRNA bands was calculated using the software UN-SCAN-IT gel version 5.1 (Silk Scientific Inc. Orem, UT, USA). *p < 0.05 compared to the cells without the treatment.
적요
이상의 연구 결과로 미루어 볼 때, 댕댕이나무 잎과 가지 추추출물은 대장암 세포주 HCT116과 SW480세포의 생육을 억제하였으나 열매추출물은 억제활성이 나타나지 않았다. 잎과 가지 추출물은 cell migration과 wound healing assay를 통해 비정상적인 세포증식 억제를 확인하였으며, β-catenin과 TCF4의 단백질 수준을 감소시켜 비정상적인 Wnt 신호전달을 억제를 통해 대장암세포의 생육을 억제하는 것으로 판단된다. 따라서 댕댕이나무 잎과 가지는 항암을 위한 대체보완소재 및 천연 항암제 개발을 위한 소재로 활용이 가능할 것으로 판단된다.